某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是 ( )
| A.肯定有SO2和NO | B.肯定只有NO |
| C.可能有Cl2和O2 | D.肯定没有Cl2、NO2,可能有O2 |
中国-094核潜艇上的核反应堆内使用了液体钠铝合金(单质钠和单质铝熔合而成,可看作二者的混合物)做载热介质,有关说法不正确的是
| A.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
| B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) |
| C.m g 钠铝合金投入足量水中,若所得溶液只含一种溶质,则其中含有钠的质量为0.46m g |
| D.若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则钠的质量分数越大 |
在离子浓度都为0.1 mol/L下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确是
| A.在含Fe3+、 Cu2+、 H+的溶液中加入锌粉:Cu 2+、 Fe3+、H+ |
| B.在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- |
| C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- |
| D.在含Fe 3+、 H+、NH4+的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+ |
有一块镁铝合金,其中镁与铝的质量比是8:9,加入足量稀硫酸使其完全溶解后,再加入NaOH 溶液,生成的沉淀的质量随NaOH 溶液体积变化的曲线如下图,其中正确的是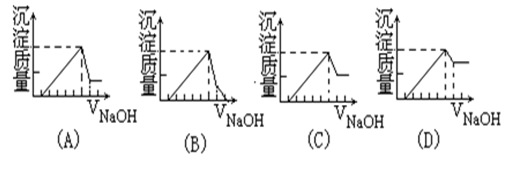
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在 |
| B.和KI溶液反应的离子方程式: Fe3++2I-=Fe2++I2 |
| C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ |
| D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe |
下列说法正确的是
| A.氨的催化氧化是一种特殊的固氮方式 |
| B.工业冶炼铝:电解熔融AlCl3固体 |
| C.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁 |
| D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |