现有CuO、FeO、Fe2O3组成的混合物m g,向其中加入100mL 1mol·L-1硫酸,恰好完全溶解,若m g该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为 ( )
| A.(m-0.8)g | B.(m-1.2)g | C.(m-1.6)g | D.无法计算 |
下列事实,不能说明氯元素的非金属性比硫元素强的是()。
| A.氯气与氢硫酸能发生置换反应 | B.HClO4酸性比H2SO4强 |
| C.盐酸是强酸,氢硫酸是弱酸 | D.受热时,氯化氢比硫化氢稳定 |
下列离子中,所带电荷数与该离子的核外电子层数相等的是()。
| A.Al3+ | B.Mg2+ | C.Be2+ | D.H+ |
下列各组顺序的排列不正确的是 ( )。
| A.离子半径:Na+ >Mg2+ >Al3+ >F- |
| B.热稳定性:HCl>H2S>PH3>AsH3 |
| C.酸性强弱: Al(OH)3<H4SiO4<H2CO3<H3PO4 |
| D.原子半径:K>Na>Mg |
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是()。
A.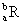 |
B.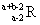 |
C.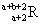 |
D.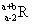 |
下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是()。
| A.6和8 | B.11和13 | C.11和16 | D.12和17 |