加碘盐的主要成分是NaCl,还添加了适量的KIO3。下列说法中正确的是
| A.KIO3和NaCl为离子化合物,均只含离子键 |
B.KIO3中阳离子的结构示意图为 |
| C.23Na37Cl中质子数和中子数之比是8∶7 |
| D.次碘酸的结构式为H—O—I |
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO )+c(HCO
)+c(HCO )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
| A.①④ | B.②⑤ | C.①③ | D.②④ |
铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL NO2气体和224 mL的NO气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
| A.7.04 g | B.8.26 g | C.8.51 g | D.9.02 g |
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.100 0 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
| A.0.008 889 | B.0.080 0 | C.0.120 0 | D.0.240 0 |
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KClO3,且 的值与温度高低有关。当n(KOH) =" a" mol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH) =" a" mol时,下列有关说法错误的是
A.参加反应的氯气的物质的量等于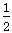 a mol a mol |
B.若某温度下,反应后 =11,则溶液中 =11,则溶液中 = =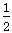 |
C.改变温度,产物中KC1O3的最大理论产量为 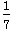 a mol a mol |
D.改变温度,反应中转移电子的物质的量ne的范围: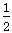 a mol ≤ ne ≤ a mol ≤ ne ≤ a mol a mol |
将25%的硫酸溶液和5%的硫酸溶液等体积混合,所得硫酸溶液的质量分数是
| A.等于15% | B.大于15% | C.小于15% | D.无法估算 |