如图所示,大试管里充满某混合气体,置于光亮处,将滴管里的水挤入大试管后,烧杯中的水会进入大试管,大试管里的气体可能是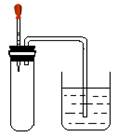
①N2、H2;②CO、O2; ③NO2、O2;④CH4、Cl2
| A.①或③ | B.②或④ | C.①或③或④ | D.③或④ |
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)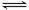 2SO3(g)△H = -197kJ/mol。实验测得起始、平衡时的有关数据如右表所示。下列叙述正确的是
2SO3(g)△H = -197kJ/mol。实验测得起始、平衡时的有关数据如右表所示。下列叙述正确的是
| 容器 |
起始各物质的物质的量/mol |
达到平衡时体 系能量的变化 |
|||
| SO2 |
O2 |
SO3 |
Ar |
||
| 甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
| 乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
| 丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量:Q3 |
A.Q1=Q2=Q3
B.达到平衡时,丙容器中SO2的体积分数最大
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.若在上述条件下反应生成2molSO3(s)的放热大于197kJ
已知(HF)2 (g) 2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是
2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是
| A.温度: T1<T2 |
| B.平衡常数:K(b)<K(c) |
| C.反应速率:vb>va |
| D.当m总/n总= 30g/mol时,n(HF):n[(HF)2]=2:1 |
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、CO32-、HCO3-、Br-等离子。火力发电燃煤排放的含有SO2的烟气可利用海水脱硫,其工艺流程如下所示:
下列说法错误的是:
| A.含SO2的烟气若不经过海水脱硫直接排放可造成酸性降雨 |
| B.“氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- |
| C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸 |
| D.“排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同 |
等质量的两份锌粉a、b,分别加入到过量的稀硫酸溶液中,并且在a中加入少量的CuSO4,下图中表示其产生H2总体积(V)与时间(t)的关系正确的是
单斜硫和正交硫转化为二氧化硫的能量变化如右图所示,下列说法正确的是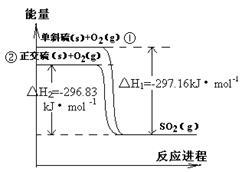
| A.S(s,单斜) = S(s,正交)△H = +0.33kJ/mol |
| B.正交硫比单斜硫稳定 |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.1molSO2(g)分解成lmol S(s,单斜)和lmol O2(g)时会放出热量 |