一定条件下,将Na与O2反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.5 mol·L—1的HCl溶液中和,则该生成物的成分是
| A.Na2O | B.Na2O2 | C.Na2O和Na2O2 | D.Na2O2和NaO2 |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是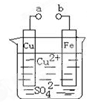
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
水的电离过程为H2O H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
KW(35℃)=2.1×10-14。则下列叙述正确的是
| A.c(H+)随温度的升高而降低 | B.35℃时,c(H+)>c(OH-) |
| C.氯化钠溶液中KW (35℃) <KW (25℃) | D.水的电离是吸热的过程 |
甲酸(HCOOH)的下列性质中,可以证明它是弱电解质的是
| A.甲酸溶液中有大量的HCOOH分子和H+、HCOO— |
| B.甲酸能与水以任意比例互溶 |
| C.10mL 1 mol/L甲酸恰好与10mL 1 mol/LNaOH溶液完全反应 |
| D.在相同温度下,相同浓度的甲酸溶液的导电性比盐酸弱 |
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量的6 mol·L-1的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
升高温度,下列数据不一定增大的是
| A.化学反应速率v | B.化学平衡常数K |
| C.水的离子积常数Kw | D.弱酸的电离常数Ka |