X、Y为短周期元素,X位于第IA族,X与Y可形成化合物X2Y,下列说法不正确的是
| A.两元素还可能形成原子个数比为1:1的化合物 |
| B.X与Y的简单离子可能具有相同电子层结构 |
| C.X的原子半径一定大于Y的原子半径 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol—1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol—1
下列说法不正确的是:
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574kJ·mol—1 |
| B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同 |
| C.若用标准状况下4.48L CH4还原NO2至N2,放出的热量为173.4kJ |
| D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总物质的量为1.6mol |
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应反应过程中H2、N2和NH3物质的量变化如下图所示,下列说法正确的是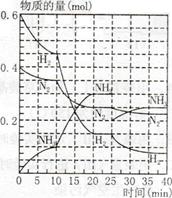
| A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min) |
| B.从曲线可以看出,反应进行到10min至20min时可能是使用了催化剂 |
| C.从曲线可以看出,反应进行至25min时,增加了0.1mol氨气 |
| D.在25min平衡正向移动但达到新平衡后NH3的体积分数比原平衡小 |
向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是
| A.d曲线代表溶液中Br—变化情况 |
| B.原溶液中FeI2的物质的量为2mol |
| C.原溶液中n(Fe2+):n(Br—)=2:3 |
| D.当通入2mol Cl2时,溶液中离子反应为:2Fe2++2I—+2Cl2=2Fe3++I2+4Cl— |
实验室欲配制一种仅含有四种离子(不考虑来源水电离的离子)的溶液,且溶液中四种离子的浓度均相等,能达到此目的的是
| A.Na+、Mg2+、SO42—、Cl— | B.ClO—、I—、NH4+、Ba2+ |
| C.Na+、AlO2—、K+、HCO3— | D.Al3+、K+、SO42—、NO3— |
如下图所示的两个实验装置,溶液的体积均为200mL。开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液的体积变化,下列叙述中正确的是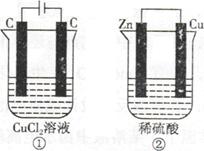
| A.产生气体的体积:①>② |
| B.溶液的pH变化:①减小,②增大 |
| C.电极上生成物质的质量:①=② |
| D.电极反应式:①中阳极2Cl—-2e—=Cl2↑,②中负极2H++2e—=H2↑ |