如图所示是用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞作指示剂)的滴定曲线。下列说法正确的是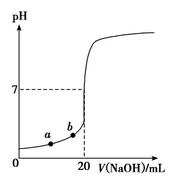
| A.水电离出的氢离子浓度:a>b |
| B.盐酸的物质的量浓度为:0.010 0 mol·L-1 |
| C.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D.当滴加NaOH溶液10.00 mL时(忽略反应前后体积变化),该混合液的pH=1+lg 3 |
用NA表示阿伏加德罗常数,下列有关叙述错误的是()
| A.臭氧与氧气的混合气体4.8g中所含有的原子总数为0.3NA |
| B.标准状况下,2.24L单质气体中含有原子数为0.2NA |
| C.在常温常压下,3.4gNH3含有的电子数是2NA |
| D.含5.4 gAl3+的硫酸铝溶液中,含有的SO42-的数目是0.3NA |
某混合气体是由HF、(HF)2、(HF)3三种气体组成,该混合气体的平均相对分子质量为38,则混合气体中HF的体积分数为: ( )
| A.大于10% | B.小于10% | C.等于10% | D.无法计算 |
相同溶质的两份溶液,一份质量分数为W1,密度为ρ1g·cm-3,浓度为amol·L-1,另一份质量分数为W2,密度为 ρ2g·cm-3,浓度为b mol·L-1,若2a=b,W2<2W1,则ρ1与ρ2的大小关系是
| A.ρ1=ρ2 | B.ρ1<ρ2 | C.ρ1>ρ2 | D.无法比较 |
如图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试根据图判断M气体可能是
| A.C3H4 | B.CO2 | C.CO | D.H2S |
由钠和氧组成的某种离子晶体含钠的质量分数是69/109,其阴离子只有过氧离子(O22-)和氧离子(O2-)两种。在此晶体中,氧离子和过氧离子的物质的量之比为
| A.2∶1 | B.1∶2 | C.1∶1 | D.1∶3 |