臭氧可用于净化空气、饮用水的消毒、处理工业废物和作氧化剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8kJ/mol.已知2Ag2O(s)=4Ag(s)+O2(g) ΔH=+62.2kJ/mol,则常温下反应: 2O3(g)=3O2(g)的ΔH= .
(2)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-=O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为 。
(3)O3在碱性条件下可将Na2SO4氧化成Na2S2O8。写出该反应的化学方程式为: 

(4)所得的Na2S2O8溶液可降解有机污染物4-CP。原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-·)。通过测定4-CP降解率可判断Na2S2O8溶液产生SO4-·的量。某研究小组设计实验探究了溶液酸碱性、Fe2+的浓度对产生SO4-·的影响。
①溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+。则由图示可知下列说法正确的是:_________________(填序号)
| A.反应开始一段时间内, 4-CP降解率随Fe2+浓度的增大而增大,其原因是Fe2+能使Na2S2O8产生更多的SO4-·。 |
| B.Fe2+是4-CP降解反应的催化剂 |
| C.当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是Fe2+会与SO4—.发生反应,消耗部分SO4—.。 |
| D.4-CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于降解反应的进行。 |
③当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解的平均反应速率的计算表达式为 。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为 。
(2)A与溴的四氯化碳溶液反应的化学方程式为 ,反应类型是 ;
(3)已知: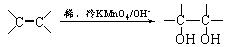 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应所得的产物 ;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应所得的产物 ;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式 ;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为 。
(Ⅰ)某化学兴趣小组从有机废液中(主要含甲苯、二甲苯、苯酚)提取苯酚的流程图如下:
请填写下列空白:
(1)A的化学式是 。
(2)振荡的目的是 。
(3)分液操作需要的玻璃仪器有 。
(4)写出水层中有关物质与A气体反应生成苯酚的化学方程式: 。
(Ⅱ)甲苯和溴乙烷混合物可通过如下流程进行分离。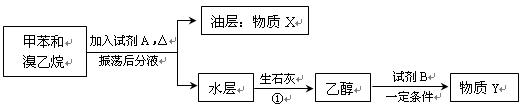
请填写下列空白:
(1)试剂A的名称为 。
(2)写出在甲苯与溴乙烷的混合物中加入试剂A时发生反应的化学方程式: 。
已知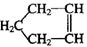 可简写为
可简写为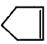
Ⅰ.降冰片烯的分子结构可表示为: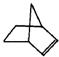
(1)降冰片烯属于__________。
a.环烷烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯不具有的性质__________。
a.能溶于水 b.能发生氧化反应
c.能发生加成反应 d.常温常压下为气体
Ⅱ.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为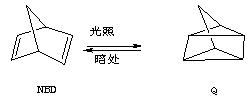
(1)NBD有多种同分异构体,其中属芳香烃的只有一种,其结构简式为,系统命名为。
(2)四环烷(Q)一氯代物共有种。
影响化反应速率的因素很多,某校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响化学反应速率的因素。
甲同学的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②___________________ |
反应速率Fe>Mg,Cu反应 |
金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________;
(2)甲同学的实验目的是_________________________;要得出正确的实验结论,还需要控制实验的条件是_____________________________;
乙同学为了更精确地研究浓度对反应速率的影响,
利用右图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是_________________________;
(4)乙同学完成该实验应选用的实验药品是_________________________。
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置;化合物M中含有的化学键类型有__________________________;用电子式表示化合物DA的形成过程:________________________________________________
(2)比较B、C、E形成的气态氢化物的稳定性(用化学式表示):>>;写出C与A形成的18e-化合物的电子式;
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:
____________________________________________________;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则负极上的电极反应式为__________________________。