下列关于SO2性质的分析,正确的是
| A.通入BaCl2溶液中,有白色沉淀生成 | B.通入FeCl3溶液中,有SO42-生成 |
| C.通入氯水中,有淡黄色沉淀生成 | D.通入KI溶液中,有I2生成 |
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是()
| A.Al2O3 | B.Al(OH)3 | C.AlCl3 | D.Al |
在一定条件下,下列物质不能和二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤硝酸 ⑥氢氧化钾 ⑦氧化钙 ⑧氮气
| A.③⑤⑦⑧ | B.⑤⑦⑧ | C.⑤⑧ | D.⑤ |
Y元素最高正价与负价的绝对值之差是6;Y元素与M元素形成的化合物在水中能电离出电子层结构相同的离子,该化合物是()
| A.KCl | B.NaF | C.Na2O | D.K2S |
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是 ()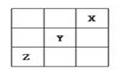
| A.Z 是活泼的金属元素 |
| B.Y的最高价氧化物的水化物是一种强酸 |
| C.1molX的单质跟足量水反应时,发生转移的电子为2mol |
| D.Y的氢化物稳定性大于Z的氢化物稳定性 |
已知短周期元素的离子aA2+、bB+、cC2-、dD- 都具有相同的电子层结构,则下列叙述正确的是()
| A.原子半径:B>A>C>D | B.原子序数:d>c>b>a |
| C.离子半径:D->C2->B+>A2+ | D.离子的还原性:D- > C2- |