在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g) △H=−92. 4kJ·mol-1)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol N2、3mol H2 |
2mol N2、6mol H2 |
2mol NH3 |
| NH3的浓度( mol·L-1) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1kJ |
放出Q2kJ |
吸收Q3kJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
A.2p1=2p3<p2 B.达到平衡时丙容器中NH3的体积分数最大
C.α2+α3<1 D.Q3+92.4 c1=92.4
某化学兴趣小组在家中进行化学实验,按照图甲连接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,由此得出的结论正确的是()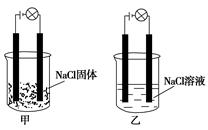
| A.NaCl是非电解质 |
| B.NaCl溶液是电解质 |
| C.NaCl是弱电解质 |
| D.NaCl在水溶液中电离出了可以自由移动的离子 |
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是()
| A |
B |
C |
D |
|
| 强电解质 |
Fe |
NaCl |
CaCO3 |
HNO3 |
| 弱电解质 |
CH3COOH |
NH3 |
H3PO4 |
Fe(OH)3 |
| 非电解质 |
C12H22O11 (蔗糖) |
BaSO4 |
C2H5OH |
H2O |
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生
反应:H2NCOONH4(s)  2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是()
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是()
| 温度 |
平衡浓度(mol·L-1) |
|
| c(NH3) |
c(CO2) |
|
| T1 |
0.1 |
|
| T2 |
0.1 |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
关于可逆反应mA(g)+nB(g)  pC(g)+qD(g)及其图象的说法正确的是()
pC(g)+qD(g)及其图象的说法正确的是()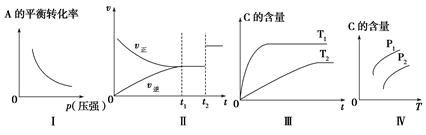
| A.若图象为Ⅰ,则m+n>p+q |
| B.若图象为Ⅱ,则m+n=p+q,t2时刻改变的条件一定是使用催化剂 |
| C.若图象为Ⅲ,则该可逆反应的ΔH<0 |
| D.若图象为Ⅳ,且压强p1>压强p2,则该可逆反应的ΔH>0 |
已知可逆反应X(g)+2Y(g)  Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是()
Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是()
| A.a点正反应速率大于逆反应速率 |
| B.增大X的浓度,X的转化率增大 |
| C.容器中压强恒定时,不能说明反应已达平衡状态 |
| D.保持温度和密闭容器的容积不变,再充入1 mol X和2 mol Y,再次达到平衡时n(Z)/n(X)的值会变小 |