工业上用煅烧石灰石制备二氧化碳。现有含杂质10%的石灰石100 t(杂质不参与反应,且不含钙元素),经高温煅烧后,若测得剩余固体中钙元素的质量分数为50%。
已知:CaCO3 CaO+CO2↑
CaO+CO2↑
通过计算回答:
(1)生成二氧化碳的质量。
(2)石灰石中的碳酸钙是否完全分解。
(10盐城2.)取黄铜屑(铜锌合金)32.5g,放入盛有180g稀硫酸(足量)的容器中充分反应,生成氢气0.4 g。试计算(请写出解题过程):
(1)该黄铜屑中铜的质量。
(2)反应的溶液蒸发掉多少克水后可变成20%的硫酸锌溶液?
(10四川甘孜23) “节能减排”已经引起当今社会普遍关注。化石燃料燃烧会产生大量的CO2,大气中CO2含量过高会导致温室效应等环境问题。
(1)计算1000g CH4完全燃烧产生CO2的质量m;
(2)从下表数据分析,与煤相比,用天然气做燃料的优点是。
| 1000g物质完全燃烧产生CO2的质量 |
1000g物质完全燃烧放出的热量 |
|
| CH4 |
m |
5.6×104KJkJ |
| C |
3.67×103g |
3.2×104KJg |
(10江苏泰州27)“钾泻盐”的化学式为MgSO4·KCl·xH2O,是一种制取钾肥的重要原料,它溶于水得到KCl与MgSO4的混合溶液。某化学活动小组为了测定“钾泻盐”中KCl的质量分数,设计了如下两种实验方案:
方案一: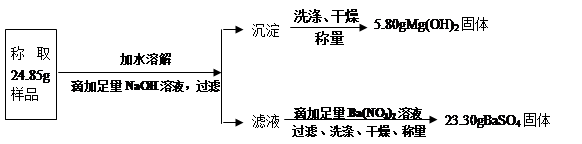
方案二: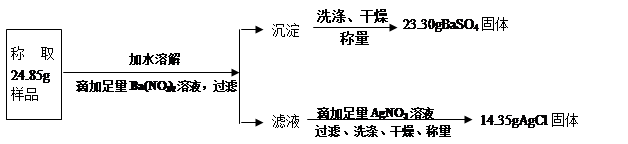
试回答下列问题:
(1)你认为方案 ▲比较合理,理由是 ▲。
(2)请选择上述方案中的数据,计算24.85g钾泻盐样品中MgSO4的质量。(写出计算过程) ▲ 。
(3)请选择上述方案中的数据,计算24.85g钾泻盐样品中KCl的质量分数。(写出计算过程) ▲。
(10海南48)为测定贝壳中碳酸钙的含量,小红将贝壳粉碎后,取样品l0g,与足量的稀盐酸充分反应(杂质不与盐酸反应),产生二氧化碳1.76g。计算贝壳中碳酸钙的质量分数。
(10泸州17).目前,市场上出现的木糖醇(化学式为C5H12O5)是一种新型甜味剂。它不能被细菌分解,添加在口香糖里取代糖份,可以防止蛀牙。试回答下列问题:
(1)木糖醇属于(填“有机物”或“无机物”);
(2)木糖醇中碳、氢、氧原子个数比是;碳、氢、氧元素质量比是;
(3)若将100g木糖醇充分燃烧(化学方程式:2C5H12O5+11O2 10CO2 +12H2O),可生成二氧化碳多少g?(计算结果保留一位小数)
10CO2 +12H2O),可生成二氧化碳多少g?(计算结果保留一位小数)