一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液。下列说法中不正确的是( )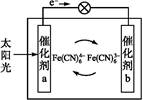
| A.K+移向催化剂b |
B.催化剂a表面发生的化学反应:Fe(CN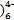 -e- -e- Fe(CN Fe(CN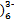 |
C.Fe(CN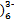 在催化剂b表面被氧化 在催化剂b表面被氧化 |
D.电解质溶液中的Fe(CN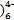 和Fe(CN 和Fe(CN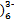 浓度基本保持不变 浓度基本保持不变 |
下列叙述正确的是()
| A.pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 |
| B.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强 |
| C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 |
| D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 |
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH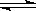 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是()
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是()
| A.加水 | B.降低温度 | C.加少量冰醋酸 | D.加CH3COONa |
向纯水中加入少量的KHSO4固体(温度不变),则溶液的()
| A.pH值减小 |
| B.c(H+)和c(OH-)的乘积增大 |
| C.酸性减弱 |
| D.OH-离子浓度增大 |
下列电离方程式书写正确的是()
A.H2S 2H++S2- 2H++S2- |
B.Al(OH)3==Al3+ + 3OH- |
C.NH3·H2O NH4+ +OH- NH4+ +OH- |
D.NaHCO3 ==Na++ H+ + CO32- |
下列物质属于强电解质且该状态下能导电的是:()
(1)氯化钠溶液;(2)氯化铵固体;(3)铜;(4)石墨;
(5)熔融NaOH;(6)稀硫酸;(7)乙酸;
| A.(1)(2)(5)(6) | B.(5) |
| C.(2)(5) | D.(1)(3)(4)(5)(6) |