工业上常用还原沉淀法处理含铬废水(Cr2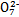 和Cr
和Cr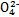 ),其流程为:Cr
),其流程为:Cr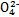
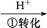 Cr2
Cr2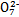
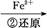 Cr3+
Cr3+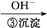 Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr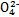 (黄色)+2H+
(黄色)+2H+ Cr2
Cr2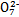 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是( )
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr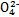 浓度增大 浓度增大 |
B.步骤①中当2v(Cr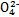 )=v(Cr2 )=v(Cr2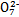 )时,说明反应2Cr )时,说明反应2Cr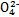 (黄色)+2H+ (黄色)+2H+ Cr2 Cr2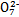 (橙色)+H2O达到平衡状态 (橙色)+H2O达到平衡状态 |
C.步骤②中,若要还原1 mol Cr2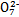 ,需要12 mol (NH4)2Fe(SO4)2·6H2O ,需要12 mol (NH4)2Fe(SO4)2·6H2O |
| D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽 |
有以下物质①NaNO3溶液②熔融的MgCl2③CuSO4粉末④NaOH固体⑤金属铜⑥蔗糖。有关它们的说法正确的是
| A.能导电的有①②③④⑤ | B.属于电解质有①②③④ |
| C.不能导电的有③④⑥ | D.属于纯净物的只有④⑤⑥ |
下列各组数值或物理量中,都不随水的“物质的量”的变化而变化的是
| A.水的沸点;水分子的数目 | B.水的密度;水的摩尔质量 |
| C.水的体积;水中所含原子的数目 | D.水的质量;水的相对分子质量 |
右图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是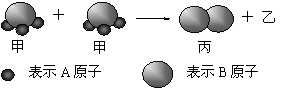
| A.化学反应中分子的种类发生了改变 |
| B.该反应类型是分解反应 |
| C.反应生成的丙物质属于单质 |
| D.根据阿佛加德罗定律可推知,1个乙分子中含有2个A原子 |
下列电离方程式书写正确的是
| A.Fe2(SO4)3=2Fe+3+3SO4-2 | B.CuCl2=Cu2++Cl2- |
| C.NaOH=Na++OH- | D.CH3COOH=CH3COO-+H+ |
下列实验操作均用到玻璃棒,其中玻璃棒的作用及其目的相同的是
①过滤②蒸发③溶解④向容量瓶转移液体
| A.①和② | B.①和③ | C.③和④ | D.①和④ |