在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
| A.2 mol·L-1 | B.2.5 mol·L-1 | C.5 mol·L-1 | D.7.5 mol·L-1 |
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
| A.再通入少量氯气,c(H+)/c(ClO-)减小 |
| B.通入少量SO2,溶液漂白性增强 |
| C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-) |
| D.加入少量固体NaOH,溶液的pH会略微增大 |
标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2,所得溶液 pH 变化如图所示。下列分析中,正确的是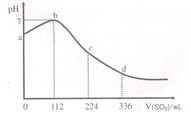
A.ab  段反应是:SO2 + 2 H2S="3S↓+2" H2O 段反应是:SO2 + 2 H2S="3S↓+2" H2O |
| B.亚硫酸是比氢硫酸更强的酸 |
C.原H2S溶液的物质的量浓度为 0.05 mol•L-1 0.05 mol•L-1 |
| D.b 点对应的溶液导电性最强 |
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
| A.(y-2x)/a | B.(y-x)/a | C.(2y-2x)/a | D.(2y-4x)/a |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3NF3 + 5H2O =" 2NO" + HNO3 + 9HF下列有关该反应的说法正确的是
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂和氧化剂的物质的量之比是2:1 |
| C.若生成0.2mol HNO3,则转移0.4mol电子 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
下列离子方程式正确的是
| A.向含0.2mol FeBr2的溶液中通入标准状况下的5.6L的Cl2: 5Cl2+4Fe2++6Br-==4Fe3++3Br2+10Cl- |
| B.次氯酸钙溶液中通入过量的二氧化硫气体ClO-+H2O+SO2==HSO-3+HClO |
| C.向硫酸亚铁溶液中通入H2S气体Fe2++H2S==FeS↓+2H+ |
| D.Cl2通入石灰乳中制取漂白粉Cl2+2OH-==Cl-+H2O+ClO- |