A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质。已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1 mol·L-1丁溶液的pH=13。下列说法中正确的是( )
A.元素B在周期表中的位置为第二周期第ⅥA族
B.元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B)
C.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol
D.1 mol甲与足量的乙完全反应共转移了约6.02×1023个电子
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
下列关于合成材料的说法中,不正确的是
| A.塑料、合成纤维和合成橡胶都属于合成材料 |
| B.聚氯乙烯可制成薄膜、软管等,其单体是CH2===CHCl |
C.合成酚醛树脂( )的单体是苯酚和甲醇 )的单体是苯酚和甲醇 |
D.合成顺丁橡胶( )的单体是CH2===CH—CH===CH2 )的单体是CH2===CH—CH===CH2 |
某物质的水溶液能导电,且该物质属于非电解质,溶于水时化学键被破坏的是
| A.液溴 | B.干冰 | C.蔗糖 | D.硫酸钡 |
下列表示物质结构的化学用语或模型正确的是
| A.羟基的电子式: | B.溴乙烷的电子式: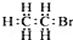 |
| C.乙醇的结构简式:CH3CH2OH | D.CH4分子的球棍模型: |
化学是你,化学是我,化学深入我们生活,下列说法正确的是
| A.木材纤维和土豆淀粉遇碘水均显蓝色 |
| B.食用花生油和鸡蛋清都能发生水解反应 |
| C.包装用材料聚乙烯和聚氯乙烯都属于烃 |
| D.PX项目的主要产品对二甲苯属于饱和烃 |