下列是某学生自己总结的一些规律,其中正确的是( )。
| A.氧化物不可能是还原产物,只可能是氧化产物 |
| B.有种化学反应不属于化合反应、分解反应、置换反应、复分解反应中的任何一种反应 |
| C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| D.将Mg(HCO3)2溶液加热,最终得到Mg(OH)2沉淀,由此可知溶解度Mg(OH)2>Mg(HCO3)2 |
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,则下列热化学方程式正确的是
A.C(s)+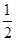 O2(g)===CO(g)ΔH=-393.5 kJ·mol-1 O2(g)===CO(g)ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)===2H2O(g)ΔH=+571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D.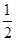 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1 |
已知2H2(g)+O2 (g)===2H2O(g) ΔH=-483.6 kJ/mol。下列说法或表达正确的是
| A.在相同的条件下,2 mol氢气与1 mol氧气的总能量小于2 mol水蒸气的总能量 |
B.H2(g)+ O2(g)===H2O(l) ΔH=-Q1 kJ/mol 则Q1>241.8 O2(g)===H2O(l) ΔH=-Q1 kJ/mol 则Q1>241.8 |
C.H2(g)+ O2(g)===H2O(l) ΔH=-Q2 kJ/mol 则Q2<241.8 O2(g)===H2O(l) ΔH=-Q2 kJ/mol 则Q2<241.8 |
| D.任何条件下,2 L水蒸气分解成2 L氢气与1 L氧气需吸收483.6 kJ热量 |
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是
| A.浓硫酸与水 | B.熟石灰与水 |
| C.生石灰与水 | D.氯化钠与水 |
下列说法正确的是
| A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的 |
| B.升高温度或加入催化剂,可以改变化学反应的反应热 |
| C.据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
| D.物质发生化学变化一定伴随着能量变化[ |
已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
| 化学物质 |
H2(g) |
Br2(g) |
HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ |
436 |
a |
369 |
则表中a为
A.404B.260C.230D.200