下列叙述正确的是(双选)( )。
| A.1 mol·L-1 NaCl溶液含有NA个Na+ |
| B.10 mL质量分数为98%的H2SO4用水稀释至100 mL,H2SO4的质量分数应大于9.8% |
| C.配制240 mL 1 mol·L-1的NaOH溶液需称NaOH固体的质量为10.0 g |
| D.配制1 mol·L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 |
下列水溶液一定呈中性的是
| A.pH=7的溶液 |
| B.c(H+)=1.0×10-7mol·L-1的溶液 |
| C.c(H+) =c(OH-) |
| D.pH=3的酸与pH=11的碱等体积混合后的溶液 |
根据下列有关图象,说法正确的是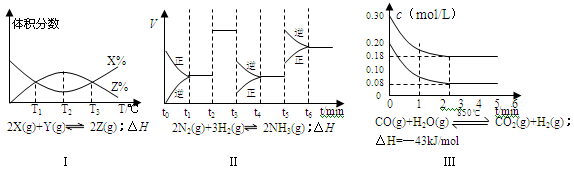
| A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 |
| B.由图Ⅱ知,反应在t6时,NH3体积分数最大 |
| C.由图Ⅱ知,t3时采取降低反应温度的措施 |
| D.图Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量 |
下列物质中能抑制水的电离且使溶液呈现出酸性的是:
| A.Na2CO3 | B.Al2(SO4)3 | C.K2SO4 | D.H2SO4 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
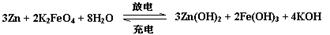 下列叙述错误的是:
下列叙述错误的是:
| A.放电时正极附近溶液的碱性增强 |
| B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C.充电时锌极与外电源负极相连 |
| D.充电时阳极反应为:Fe(OH)3— 3e-+ H2O |
向足量H2SO4溶液中加入100mL 0.4 mol·L—1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L—1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-2.92kJ·mol—1 |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-0.72kJ·mol—1 |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-73kJ·mol—1 |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-18kJ·mol—1 |