在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3—(aq)。测得不同温度下该反应的平衡常数K如表所示:
I3—(aq)。测得不同温度下该反应的平衡常数K如表所示:
| t/℃ |
5 |
15 |
25 |
35 |
50 |
| K |
1 100 |
841 |
689 |
533 |
409 |
下列说法正确的是( )。
A.反应I2(aq)+I-(aq) I3—(aq)的ΔH>0
I3—(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I3—)减小
C.该反应的平衡常数表达式为K=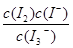
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
下列反应中,属于取代反应的是
| A.苯与液溴反应 | B.乙烯使溴的四氯化碳溶液褪色 |
| C.乙烷在空气中燃烧 | D.乙烷与氯气在光照下颜色变浅 |
某原电池如右图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液。则A、B、C为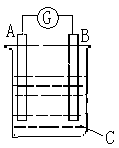
A.A是Zn,B是Cu,C是稀H2SO4
B.A是Cu,B是Zn,C是稀H2SO4
C.A是Ag,B是Fe,C是稀AgNO3溶液
D.A是Fe,B是Ag,C是稀AgNO3溶液
下列说法正确的是
| A.糖类、油脂和蛋白质都是高分子化合物 |
| B.蛋白质的盐析和变性都是化学变化 |
| C.石油的分镏和煤的干镏都是物理变化 |
| D.乙醇和乙酸都能与金属钠发生反应 |
对于任一化学反应,用E(反应物)表示反应物的总能量,用E(生成物)表示生成物的总能量,用E(吸收)表示反应过程吸收的能量,用E(放出)表示反应过程放出的能量,则反应热△H可表示为:
①E(反应物)-E(生成物)②E(生成物)-E(反应物)
③E(吸收)-E(放出)④E(放出)-E(吸收)
| A.①③ | B.②④ | C.②③ | D.①④ |
下列关于苯的说法中,正确的是
| A.苯分子为平面正六边形结构,6个碳原子之间的键完全相同 |
| B.苯的分子式是C6H6,不能使酸性KMnO4溶液褪色,所以属于饱和烃 |
C.从苯的凯库勒式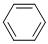 看,分子中含有双键,所以属于烯烃 看,分子中含有双键,所以属于烯烃 |
D.在催化剂作用下,苯与液溴反应生成溴苯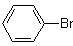 ,发生了加成反应 ,发生了加成反应 |