一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=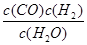 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为______________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
| A.v正(H2O)=v逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗n mol H2的同时消耗n mol CO |
| D.容器中物质的总物质的量不随时间改变 |
(3)该反应的v正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是________、________。
(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
A、B、C、D、E为原子序数依次增大的五种短周期主族元素。其中B原子最外层电子数是次外层的3倍。A、C与B相邻,D最外层只有1个电子,E单质既能与强酸反应,又能与强碱反应。下列比较正确的是()
A.最高正价:C>E>A B.气态氢化物稳定性:C>B>A
C.原子半径:B>D>A D.原子失电子能力:D>C>E
下列各溶液中,一定能大量共存的离子组是()
| A.室温下,由水电离出c(OH-)=1×10-12 mol·L-1的溶液中:K+、HCO3-、Na+、Cl- |
| B.含有0.1 mol·L-1 Fe2+的溶液中:NH4+、SO42-、H+、NO3- |
| C.澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl- |
| D.室温下,pH=1的溶液中:Na+、Cl-、K+、CH3COO- |
下列有关化学实验图像表现的内容错误的是()
| A.铜锌原电池 | B.转移溶液 | C.氨的制取装置 | D.模拟铁锈蚀装置 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是()
| A.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数目为0.1NA |
| B.标准状况下,11.2 L的Cl2溶于水,转移的电子总数为0.5NA |
| C.14 g乙烯、丙烯的混合气体,含有C一H键数为2NA |
| D.标准状况下,2.24 LCH2Cl2中含有C1原子数为0.2NA |
下列有关化学用语正确的是()
| A.一CH3的电子式: | B. P原子的结构示意图; P原子的结构示意图; |
| C.醛基的结构简式:一COH | D.质量数为2的重氢原子: 1 2H 1 2H |