(1)[2013·四川理综,11(4)]以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2该电池反应的化学方程式是______________________________。
(2)[2013·重庆理综,11(2)]化学在环境保护中起着十分重要的作用,催化反硝化学法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3—的原理如图所示。
①电源正极为__________(填A或B),阴极反应式为__________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为__________克。
(3)[2013·新课Ⅱ,36(1)]锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图所示。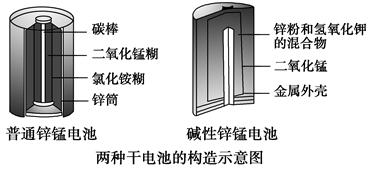
回答下列问题:
普通锌锰电池放电时发生的主要反应为
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是_____________________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是________________。
某学习小组用右图装置进行了有关电化学的实验。在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅拌棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。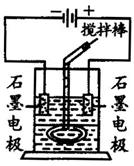
根据上述实验回答:
(1)阳极上的电极反应式为_______________________。
(2)环状玻璃搅拌棒的作用是______________________。
(3)原上层液体是___________。
(4)原下层液体是___________。
(5)搅拌后两层液体颜色发生变化的原因是:___________________________________________。
(6)要检验上层液体中含有的金属离子,其方法是__________,现象是___________________。
(10分)某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
| 实验编号 |
0.01mol·L-1 酸性KMnO4溶液 |
0.1mol·L-1 H2C2O4溶液 |
水 |
1mol·L-1 MnSO4溶液 |
反应温度 /℃ |
反应时间 |
| I |
2mL |
2mL |
0 |
0 |
20 |
125 |
| II |
____mL |
____mL |
1mL |
0 |
20 |
320 |
| III |
____mL |
___mL |
___mL |
0 |
50 |
30 |
| IV |
2mL |
2mL |
0 |
2滴 |
20 |
10 |
已知:反应的方程式(未配平):KMnO4 + H2C2O4 + H2SO4 —— K2SO4 + MnSO4 + CO2↑+ H2O
(1)实验记时方法是从溶液混合开始记时,至________时记时结束。
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响。请在上表空格中填入合理的实验数据。
(3)从实验数据分析,实验I和IV研究________对反应的影响。
(4)请配平上面的化学方程式:
KMnO4 +H2C2O4 + H2SO4=K2SO4 + MnSO4 + CO2↑+ H2O
低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)该反应逆反应的化学平衡常数表达式为K =。
(2)上述正反应方向是反应(填“放热”或“吸热”)。
(3)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=mol·L-1·min-1。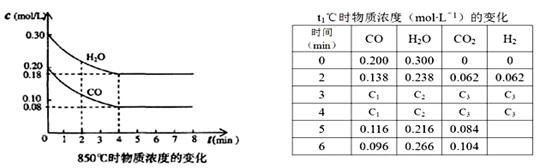
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
①表中3 min~4 min之间反应处于状态;C1数值0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是(单选),表中5 min~6 min之间数值发生变化,可能的原因是(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为:。
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: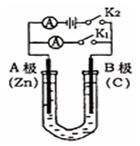
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A为极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是,Na+移向极(填A、B);B电极上的电极反应式为,总反应化学方程式是 。
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),电极反应式是 ,反应一段时间后电解质溶液中Cu2+的浓度将会(填“增大”、“减小”、“不变”)。
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为:。
(2)今有如下两个热化学方程式:则ab(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g)ΔH1=a kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l)ΔH2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g)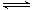 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ;
CH3OCH3(g) + CO2 (g)的ΔH= ;