下列实验能达到预期目的的是(双选) ( )。
| A.将K投入NaCl溶液中,比较K与Na的还原性强弱 |
| B.用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
| C.配制0.01 mol·L-1FeCl2溶液后,向溶液中加入少量铁粉防氧化 |
| D.为加快稀硫酸和锌粒反应制氢气的速率,向溶液中加入少许硝酸铜 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )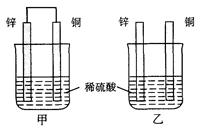
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是()
| A.正极反应为:O2+2H2O+4e-=4OH- |
| B.电池工作时,电流由铝电极沿导线流向铂电极 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.该电池通常只需要更换铝板就可继续使用 |
有A、B、C、D四块金属片,进行如下实验:①将A、B用导线连接后,同时浸入稀硫酸溶液中,B极上有气泡产生;②C、D用导线连接后,同时浸入稀硫酸溶液中,电流由D 导线
导线 C;③A、C相连后,同时浸入稀硫酸溶液中,C极上产生大量气泡;④B、D用导线连接后,同时浸入稀硫酸溶液中,D极上发生氧化反应。据此判断四种金属的活动性顺序为()
C;③A、C相连后,同时浸入稀硫酸溶液中,C极上产生大量气泡;④B、D用导线连接后,同时浸入稀硫酸溶液中,D极上发生氧化反应。据此判断四种金属的活动性顺序为()
A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>D>C>A
银锌电池广泛用做各种电子仪器的电源,它的充电和放电过程可以表示为:
2Ag+Zn(OH)2 Ag2O+Zn+H2O。此电池放电时,负极上发生反应的物质是()
Ag2O+Zn+H2O。此电池放电时,负极上发生反应的物质是()
| A.Ag | B.Zn(OH)2 | C.Ag2O | D.Zn |
下列叙述正确的是()
①原电池是把化学能转化成电能的一种装置
②原电池的正极发生氧化反应,负极发生还原反应
③不能自发进行的氧化还原反应,通过原电池的装置均可以实现
④碳棒不能用来作原电池的电极
⑤反应Cu+2Ag+=2Ag+Cu2+,能以原电池的形式来实现
| A.①⑤ | B.①④⑤ | C.②③④ | D.②⑤ |