氧化铜矿中含有主要杂质为Fe2+和Al3+等,用其生产CuSO4·5H2O主要工艺流程如下图。
(1)图中加入氧化剂的目的是 ,结合下表回答除铁步骤的最佳pH范围为 。
(2)氧化剂若选用KMnO4,会降低产品的纯度,其原因是 ,实际生产中NaClO作为最佳氧化剂,发生反应的离子方程式为 。
(3)请在下图中完善所缺步骤及所添加试剂的化学式。可供选择的操作有:萃取、蒸发浓缩、过滤、洗涤、降温结晶、蒸馏、分液。
某烷烃A与炔烃B的混合气体1 mol的质量为25.6 g,取标准状况下的此混合气体6.72 L通入足量的溴水中,结果溴水质量增加4.8 g,由此推断A为________,B为__________.
在一定条件下,某些不饱和烃分子可以进行自身加成反应,例如:
有机物甲的结构简式为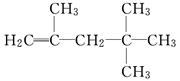 ,它是由不饱和烃乙的两个分
,它是由不饱和烃乙的两个分
子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是_____________________________________________________,
丙的结构简式是______________________________________________________.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液退色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去杂质,再与溴水反应.
(1)写出甲同学实验中两个主要的化学方程式:_____________________________
________________________________________________________________________.
(2)甲同学设计的实验________(填“能”或“不能”)验证乙炔与溴发生加成反应,理由
是________.
a.使溴水褪色的反应未必是加成反应
b.使溴水褪色的反应就是加成反应
c.使溴水褪色的物质未必是乙炔
d.使溴水褪色的物质就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是________,在验证过程中必须全部
除去,它与溴水反应的化学方程式是______________________________________.
设计方案以电石(CaC2)、H2、Cl2、蒸馏水为原料,合成聚氯乙烯塑料,写出涉及反应的化学方程式.
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
右图中的实验装置可用于制取乙炔.
请填空:
(1)图中,A管的作用是________________________________
____________________________________________________,
制取乙炔的化学方程式是_______________________________
________________________________________________________________________.
(2)乙炔通入KMnO4酸性溶液中观察到的现象是______________________________,乙炔发生了________反应.
(3)乙炔通入溴的CCl4溶液中观察到的现象是______________________________,乙炔发生了________反应.
(4)为了安全,点燃乙炔前应______________________,乙炔燃烧时的实验现象是________________________________________________________________________.