利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的是( )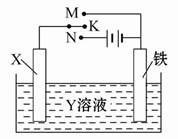
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
下列说法正确的是()
| A.凡是放热反应都是自发的 |
| B.难溶电解质的溶解平衡是一种动态平衡 |
| C.利用沉淀反应除杂时,可使杂质离子完全沉淀 |
| D.pH=5的盐酸稀释1000倍后,溶液的pH增到8 |
将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为()
| A.1∶2∶3 | B.3∶2∶1 | C.6∶3∶1 | D.6∶3∶2 |
在0.1mol/L的氨水中存在 NH3·H2O  NH4++OH-的电离平衡,下列措施都能使该平衡向右移动的一组是 ( )
NH4++OH-的电离平衡,下列措施都能使该平衡向右移动的一组是 ( )
①加入少量HCl ②加入固体NaOH ③加水 ④通入氨气
⑤加热升高温度 ⑥加入NH4NO3
| A.①③④⑤ | B.①③④⑤⑥ | C.②③④⑤ | D.①③④⑥ |
关于盐类水解反应的说法正确的是( )
| A.溶液呈中性的盐一定是强酸与强碱生成的盐 |
| B.含有弱酸根离子的盐的水溶液一定呈碱性 |
| C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小 |
D.Na2 S水解的离子方程式为:S2-+2H2O H2S+2OH- H2S+2OH- |
常温下列各种溶液中,可能大量共存的离子组是()
| A.pH=0的溶液中:Fe2+、NO3-、SO42-、I- |
| B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、AlO2-、S2-、CO32- |
| C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3- |
| D.能使PH试纸显红色的溶液:Mg2+、SO42-、Na+、Cl- |