下列反应的离子方程式正确的是( )
| A.足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2=2Fe3++2Cl- |
B.亚硫酸氢铵和氢氧化钠的反应: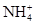 +OH- +OH-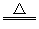 NH3↑+H2O NH3↑+H2O |
| C.二氧化硫气体通入过量的Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
D.Ca(HCO3)2溶液与少量NaOH溶液反应: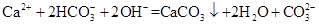 |
常温常压下,下列气体混合后压强一定不发生变化的是
| A.NH3和Cl2 | B.NH3和HBr | C.SO2和O2 | D.SO2和H2S |
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g) 3 FeS(s)+4 H2O(g),其温度与平衡常数的关系如图所示。对此反应原理的理解正确的是
3 FeS(s)+4 H2O(g),其温度与平衡常数的关系如图所示。对此反应原理的理解正确的是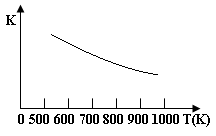
| A.H2S是还原剂 |
| B.脱除H2S的反应是放热反应 |
| C.温度越高H2S的脱除率越大 |
| D.压强越小H2S的脱除率越高 |
在化学能与电能的转化中,下列叙述正确的是
| A.镀锌铁皮在食盐水中发生析氢腐蚀 |
| B.电解池的阴极材料一定比阳极材料活泼 |
| C.将铁器与电源正极相连,可在其表面镀锌 |
| D.原电池的负极和电解池的阳极均发生氧化反应 |
工业上以CaO和HNO3为原料制备Ca(NO3)2•6H2O晶体。为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为
| A.53.8% | B.58.3% | C.60.3% | D.70.0% |
为了实现绿色化学,符合工业生产实际的是
| A.用纯碱吸收硫酸工业的尾气 | B.用烧碱吸收氯碱工业的尾气 |
| C.用纯碱吸收合成氨工业的尾气 | D.用烧碱吸收炼铁工业的尾气 |