如图中的所有物质均由短周期元素组成。其中甲、乙、丙、丁为单质,常温下甲、乙为无色气体,丁为黄绿色气体。丙是常见金属,广泛用于航天、航空工业。工业上从海水中提取G后再通过电解G制取丙,同时得到副产物丁。A、E的分子中均含10个电子,A是一种能使湿润的红色石蕊试纸变蓝的气体,E在常温下是无色无味的溶液。框图中各物质转化所涉及的条件均已省略。回答下列问题: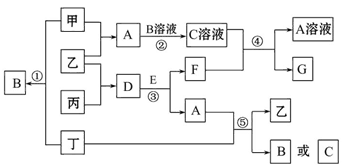
(1)反应①~⑤中属于氧化还原反应的是_________(填序号)。
(2)画出丙的原子结构示意图_________,写出A的电子式_________,写出A、B的等电子体(原子数和电子数均相等的粒子) _________、_________ (用化学式表示)。
(3)C的水溶液显酸性,用离子方程式解释_______________________________
_______________________________________________________________________________。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
2H2(g)+O2(g)=2H2O(l) △H=—285.8 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
则反应CO(g)+2H2(g)=CH3OH(l)的△H=_______。
(2)工业上合成甲醇一般采用下列反应:CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
CH3OH(g) △H="—a" kJ/mol(a>0),H2的平衡转化率与温度、压强的关系如下图所示。
压强:P1 P2(填“>”、“=”或“<”)。
(3)在容积固定的密闭容器中发生CO(g)+2H2(g) CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
CH3OH(g) △H="—a" kJ/mol(a>0),各物质的浓度如下表:
| 浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH) |
| 0 |
0.8 |
1.6 |
0 |
| 2 |
0.6 |
1.2 |
0.2 |
| 4 |
0.3 |
0.6 |
0.5 |
| 6 |
0.3 |
0.6 |
0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂B.降低温度C.增加H2的浓度
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。
①写出阳极电极反应式_____________________________________;
②写出除去甲醇的离子方程式_______________________________。
【化学——有机化学基础】(共15分)
(1)今有如下图所示的三种有机物:
①写出丙中含氧官能团的名称 ;
②这三种物质中,互为同分异构体的是 ;
③写出乙和过量NaOH溶液共热时反应的化学方程 。
(2)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
①A的同分异构体还有 种;
②聚合物F的结构简式是 ;
③B转化为C的化学方程式是 ;
写出与E具有相同官能团的一种同分异构体的结构简式 ;
I.甲、乙、丙、丁四种物质存在转化关系:
(1)若甲、乙均为空气主要成分,则丁与水反应的化学方程式为 。
(2)若甲为常见的固体非金属单质,丙可使品红溶液褪色,则丁为____________。
(3)若乙是生活常见金属单质,丙→丁的离子方程式为 。
(4)若丙既能与强酸又能与强碱反应,则丙的化学式为 (任写1种)。
II.一定温度下,容积为1 L的密闭容器中投入0.5 mol PCl5(g),存在平衡:PCl5(g) PCl3(g)+ Cl2(g)。反应过程中测得部分数据如下表:
PCl3(g)+ Cl2(g)。反应过程中测得部分数据如下表:
| 时间 |
n(PCl5)/mol |
n(PCl3)/mol |
n(Cl2)/mol |
| 0 |
0.5 |
0 |
0 |
| t1 |
0.45 |
||
| t2 |
0.1 |
||
| t3 |
0.4 |
(5)t1时刻,测得反应吸收的热量为a kJ。PCl3(g)与Cl2(g)反应的热化学反应方程式为 。
(6)t2时:v正 v逆(填“>”、“<”或“=”)。
(7)计算该反应的化学平衡常数K=_____________。相同温度下,改为往容器中投入0.2 mol PCl5(g)、0.2 mol PCl3(g)、0.1 mol Cl2(g),到达平衡前,PCl5的物质的量将 (填“增大”、“减小”、“不变”)。
选做[化学一选修5:有机化学基础)芳香族化合物水杨酸、冬青油、阿司匹林都是常用西药。它们的结构简式如下表:
(1)水杨酸分子中式量较大的含氧官能团名称是 。
(2)水杨酸在浓硫酸催化作用下与乙酸酐(CH3C0)20反应生成阿司匹林,反应的化学方程 。
(3)水杨酸在一定条件下可以聚合成高分子化合物聚水杨酸,聚水杨酸的结构简式为: 。
(4)写出冬青油的一种同分异构体结构简式:_____________________
异构体符合以下条件:
①芳香族化合物;
②苯环上一个氢原子被氯取代,有两种可能的产物;
③在足量氢氧化钠溶液中充分反应消耗等物质的量氢氧化钠。
(5)阿司匹林晶体中残留少量的水杨酸,可用 _____________(填试剂名称)检验.
实验室利用阿司匹林和水杨酸在乙酸乙酯中溶解度的差异,用结晶法提纯阿司匹林,请完成以下实验操作步骤:
①用少量热的乙酸乙酯溶解晶体.②________③经__________操作得到纯净的阿司匹林晶体。
(6)效更佳的长效缓释阿司匹林( )在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为 ,反应类型为 。
)在人体内可缓慢释放出阿司匹林分子,反应的化学方程式为 ,反应类型为 。
选做【化学——选修3:物质结构与性质】A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为 。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1)。则1molA的这种单质中π键的数目为 。
(4)X元素对应的单质在形成晶体时,采用如图2所示的堆积方式。
则这种堆积模型的配位数为 ,如果X的原子半径为a cm,阿伏加德常数的值为NA,则计算此单质的密度表达式为 g/cm3(不必化简)。