用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是 ( )。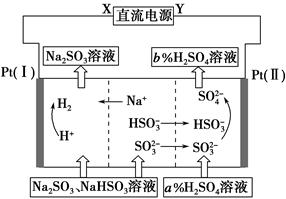
| A.X为直流电源的正极,Y为直流电源的负极 |
| B.阴极的电极反应式为2H++2e-=H2↑ |
| C.该过程中的产品主要为H2SO4和H2 |
| D.图中的b>a |
下列说法正确的是
| A.SO2能使FeCl3、KMnO4溶液褪色 | B.用澄清石灰水可鉴别CO2和SO2 |
| C.S在O2中燃烧可生成SO3 | D.SO2通入BaCl2溶液中能产生白色沉淀 |
元素A的阳离子与元素B的阴离子具有相同的电子层结构,以下关于A、B元素性质的比较中,正确的是:①原子半径:A<B②原子序数:A>B ③原子最外层电子数:B>A④元素所在的周期数:A>B⑤A的最高正价与B的最低负价的绝对值相等
A.②③④ B.①② C.④⑤ D.②⑤
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是
| A.气态氢化物的稳定性:HX>H2Y>ZH3 |
| B.非金属活泼性:Y<X<Z |
| C.原子半径:X>Y>Z |
| D.原子最外电子层上电子数的关系:Y=X+Z |
下列过程中,共价键被破坏的是
| A.碘升华 | B.溴蒸气被木炭吸附 | C.NaCl溶于水 | D.HI气体受热分解 |
在短周期元素中,原子最外电子层只有1个或2个电子的元素肯定是
| A.金属元素 | B.稀有气体元素 |
| C.非金属元素 | D.无法确定为哪一类元素 |