碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。以下说法正确的是 ( )。
| A.电池工作时,MnO2失去电子 |
| B.电池工作时,电子由锌经外电路流向MnO2 |
| C.从反应方程式来看,不使用氢氧化钾,也不影响电流大小 |
| D.电池的正极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) |
下列离子方程式书写正确的是()
A.Na与H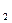 O反应:Na+2H O反应:Na+2H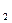 O O Na Na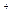 +2OH +2OH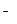 +H +H ↑ ↑ |
B.Na O与盐酸反应:O O与盐酸反应:O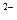 +2H +2H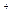  H H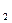 O O |
C.NaHCO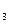 溶液与稀硫酸反应:CO 溶液与稀硫酸反应:CO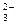 +2H +2H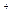  CO CO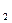 ↑+H ↑+H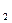 O O |
D.NaOH溶液与小苏打溶液混合:HCO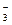 +OH +OH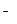  CO CO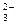 +H +H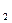 O O |
取一小块金属钠,放在燃烧匙里加热,下列实验现象中,描述正确的是()
①钠先熔化②在空气中燃烧,放出黄色火花③燃烧后得到白色固体④燃烧时火焰为黄色⑤燃烧后生成淡黄色固体物质
| A.①② | B.①②③ | C.①④⑤ | D.④⑤ |
过氧化钠与足量的碳酸氢钠固体混合后,在密闭容器中充分加热,排出气体物质后冷却,残留的固体物质是( )
| A.Na2O2、Na2CO3 |
| B.Na2CO3 |
| C.Na2CO3、NaOH |
| D.Na2O2、NaOH、Na2CO3 |
在一定温度下,向足量的饱和Na2CO3溶液中加入1.06 g无水碳酸钠,搅拌后静置,最终析出晶体的质量()
| A.等于1.06 g |
| B.大于1.06 g而小于2.86 g |
| C.等于2.86 g |
| D.大于2.86 g |
下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( )
| A.Na2O2与CO2 |
| B.Na与O2 |
| C.NaOH与CO2 |
| D.C与O2 |