镁燃料电池作为一种高能化学电源,具有良好的应用前景。如图是镁-空气燃料电池工作原理示意图。下列有关该电池的说法正确的是 ( )。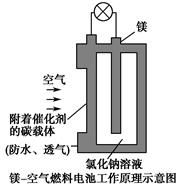
| A.该电池Mg作负极,发生还原反应 |
| B.该电池的正极反应式为O2+2H2O+4e-=4OH- |
| C.电池工作时,电子通过导线由碳电极流向Mg电极 |
| D.当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L |
X、Y、Z、W均为短周期元素,它们在周期表中的位置如下图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.Z、W的气态氢化物还原性:W > Z |
| D.四种元素的单质中,Z单质的熔沸点最高 |
工业上合成氨的反应为N2(g)+3H2(g)  2NH3(g ),为了增大反应速率,提高经济效益,最理想的措施是
2NH3(g ),为了增大反应速率,提高经济效益,最理想的措施是
| A.增大反应物的浓度 | B.增大反应体系的压强 |
| C.提高反应体系的温度 | D.选择合适的催化剂 |
下列说法正确的是
| A.在周期表中,族序数都等于该族元素的最外层电子数 |
| B.碱金属随原子序数增大,熔沸点逐渐降低;卤素单质随原子序数的增大,熔沸点逐渐升高 |
| C.同周期的主族元素从左到右原子半径逐渐减小,它们形成简单的离子半径逐渐增大 |
| D.非金属性最强的元素,其最高价氧化物对应水化物的酸性最强 |
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大。Z和N可以形成ZN2型化合物。下列有关说法正确的是
| A.X与Y只能形成一种化合物 |
| B.最高价氧化物对应水化物的碱性: Y>Z |
| C.气态氢化物的热稳定性:M>N |
| D.单质的氧化性:X<M |
已知:①2C(s)+O2(g)===2CO(g)ΔH=-221.0 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(g)ΔH=-483.6 kJ·mol-1。
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为
| A.+262.6 kJ·mol-1 | B.-131.3 kJ·mol-1 |
| C.-352.3 kJ·mol-1 | D.+131.3 kJ·mol-1 |