常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是 ( )。
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+ c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 mL |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32—)=c(HCO3—)>c(H+)>c(OH-) |
下列各表述与示意图一致的是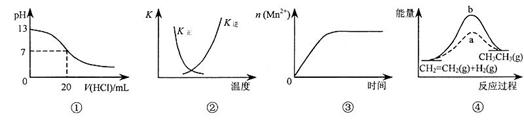
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g)+ O2(g) 2SO3(g)+Q(Q>0)正、逆反应的平衡常数K随温度的变化 2SO3(g)+Q(Q>0)正、逆反应的平衡常数K随温度的变化 |
C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时(Mn2+是该反应的催化剂),n(Mn2+) 随时间的变化 H2C2O4溶液混合时(Mn2+是该反应的催化剂),n(Mn2+) 随时间的变化 |
D.图④中a 、b曲线分别表示反应CH2=CH2(g)+ H2(g) 、b曲线分别表示反应CH2=CH2(g)+ H2(g) CH3CH3(g) +Q(Q>0),使用和未使用催化剂时,反应过程中的能量变化 CH3CH3(g) +Q(Q>0),使用和未使用催化剂时,反应过程中的能量变化 |
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是()
A.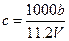 |
B.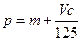 |
| C.n="m+17Vc" | D.p=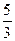 m m |
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
| A.a 点表示的溶液中c(CH3COO—)=10—3 mol/L |
| B.b 点表示的溶液中c(Na+)> c(CH3COO—) |
| C.c 点表示CH3COOH和NaOH恰好反应完全 |
D.b、d 点表示的溶液中 均等于K 均等于K |
下列离子方程式书写正确的是
| A.向明矾溶液中加入过量的氢氧化钡溶液: Al3+ + 2SO42- +2Ba2+ + 4OH- →2BaSO4↓+ AlO2- + 2H2O |
B.碳酸钠溶液中 通入少量二氧化碳气体:CO32—+CO2+H2O→2HCO3— 通入少量二氧化碳气体:CO32—+CO2+H2O→2HCO3— |
C.醋酸钠水溶液中通入足量CO2:2CH3C OO— + CO2 + H2O→ 2CH3COOH + CO2— 3 OO— + CO2 + H2O→ 2CH3COOH + CO2— 3 |
| D.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合 |
Ca2++2HCO3—+2OH—→CaCO3+CO32—+2H2O
对实验Ⅰ~Ⅳ的实验现象预测正确的是
| A.实验Ⅰ:液体分层,下层呈无色 |
| B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C.实验Ⅲ:试管中溶液颜色变为红色 |
| D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |