如图是某硫酸试剂瓶标签上的部分文字。据此,下列说法正确的是( )
| 硫酸 化学纯(CP)(500 mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84 g/cm3 质量分数:98% |
A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2 mol/L
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol
25°C时,c(CH3COOH)+c(CH3COO-)=0.1 mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、
c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是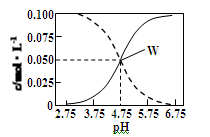
| A.pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-) |
| C.由W点可以求出25°C时CH3COOH的电离常数 |
| D.pH =4的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol/L |
根据原子结构及元素周期律的知识,下列叙述正确的是
| A.由于相对分子质量:HCl>HF,故沸点:HCl>HF |
| B.硅处于金属与非金属的过渡位置,硅可用作半导体材料 |
| C.由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 |
| D.Cl-、S2-、Ca2+、K+半径逐渐减小 |
下列说法不正确的是
| A.金属单质和盐溶液的反应不一定是置换反应 |
| B.质量数相等的不同核素,一定属于不同种元素 |
| C.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则原溶液中一定有SO42- |
| D.Al2O3既能与强酸反应,又能与强碱反应,Al2O3属于两性氧化物 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| B.用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA |
| C.已知3BrF3+5H2O=HBrO3+Br2+9HF+O2↑ 如果有5mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA |
| D.142g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
下列说法正确的是
| A.石油经过分馏及裂化等方法得到的物质均为纯净物 |
| B.乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 |
C.化合物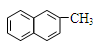 是苯的同系物 是苯的同系物 |
| D.异丁烷的八氯代物共有3种(不考虑立体异构) |