有以下物质:①液氨;②氨水;③盐酸;④醋酸;⑤硫酸钡;⑥银;⑦氯化钠晶体;⑧二氧化碳;⑨醋酸铵;⑩酒精溶液。
(1)属于电解质的是_____________________________________________________________;
(2)能导电的是_________________________________________________________________;
(3)属于强电解质的是___________________________________________________________。
下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。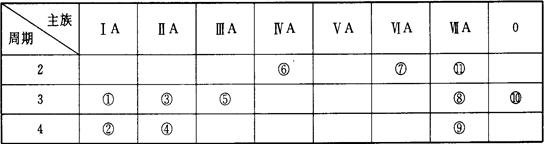
(1)化学性质最不活泼的元素是(填元素符号或化学式,下同),
非金属性最强的元素是。
金属性最强的单质与水反应的离子方程式是
。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是
(3)①②③三种元素的原子半径由大到小的顺序是>>。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水,又能和碱反应
生成盐和水,该元素的最高价氧化物和盐酸反应的离子方程式为
。
向该元素和⑧号元素形成的化合物的溶液中,缓慢滴加氨水至过量,产生的实验现象是,有关反应的化学方程式为。(5)⑥元素形成的单质与浓硝酸发生化学反应的化学方程式为
。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。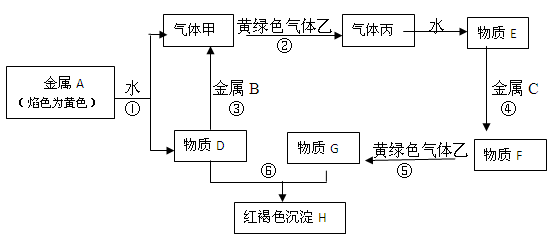
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A、B、C
甲、乙、H
(2)写出下列反应的离子方程式:
反应⑤
反应⑥
(12分)配平下列各氧化还原反应方程式(将系数填写在相应横线上,并按要求填空)
⑴ ___ KMnO4+ ___ HCl =" _____" MnCl2+ _____ KCl + ____ Cl2 ↑ + ___ H2O
⑵_____ HNO3 = ___NO2 ↑ + _____ O2 ↑+ _____H2O
配平如下反应方程式并标注电子转移的方向和数目
⑶_____Na +____Cu2+ + ____H2O ==______Na+ + ____Cu(OH)2 ↓ + ____H2 ↑
该反应的氧化剂是;若转移的电子数是1mol,得到H2mol
A、B、C、D、E五种短周期元素。A元素所处的周期数、主族序数、原子序数均相等;B元素原子的半径是其所在主族中最小的,其最高价氧化物对应水化物的化学式为HBO3;C元素原子最外层上的电子数为内层电子数的2倍;元素D的二价阴离子与E的阳离子的核外电子排布相同;E元素的周期数比族序数多2。请回答:
(1) 写出元素的符号:A; B____________。
(2)画出D离子的结构示意图________________________,
C在周期表的位置为;
(3)C的最高价氧化物的电子式是;
E与D的单质在常温下反应的生成物电子式为,E与D按原子数1∶1化合而成的物质所含化学键类型为。
(4) A与D可形成三种电子总数为10的微粒,其中形成分子的结构式为,写出另二种微粒其中一种的化学式; A与D还可形成电子总数为18的微粒,该微粒的化学式为。
(9分 ) (1)已知在 2L的容器中进行下列可逆反应,各物质的有关数据如下:
aA (g)+ bB (g)  2C(g)
2C(g)
起始物质的量(mol): 3 2 0
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则① a =,b =;
② 2S内B的反应速率=。
(2) 1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO
反应的热化学方程式。