已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-a kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-b kJ/mol
H2O(g)=H2O(l) ΔH3=-c kJ/mol
若使92 g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
| A.4a+4b+4c | B.2a-2b+6c |
| C.2a-2b+2c | D.2a-6b+2c |
可逆反应mA(g)+nB pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 ( )。
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是 ( )。
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率都增大
下列实验事实不能用平衡移动原理解释的是 ( )。
A.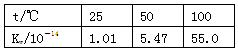
B.
C.
D.
已知三个热化学方程式:
(1)I2(g)+H2(g)2HI(g) ΔH=-9.48 kJ·mol-1
(2)I2(s)+H2(g)2HI(g) ΔH=+26.48 kJ·mol-1
(3)C(石墨,s)=C(金刚石,s) ΔH>0
下列判断正确的是 ( )。
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
| D.金刚石比石墨稳定 |
已知反应:
①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列结论正确的是 ( )。
| A.碳的燃烧热的数值大于110.5 kJ·mol-1 |
| B.①的反应热为221 kJ·mol-1 |
| C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
在同温同压下,下列各组热化学方程式中ΔH1>ΔH2的是 ( )。
| A.2H2(g)+O2(g)=2H2O(l) ΔH1;2H2(g)+O2(g)=2H2O(g) ΔH2 |
| B.S(g)+O2(g)=2SO2(g) ΔH1;S(s)+O2(g)=2SO2(g) ΔH2 |
C.C(s)+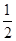 O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2 O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2 |
D.H2(g)+Cl2(g)=2HCl(g) ΔH1;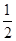 H2(g)+ H2(g)+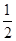 Cl2(g)=HCl(g) ΔH2 Cl2(g)=HCl(g) ΔH2 |