2013年春季,全国各地持续出现严重的雾霾天气,给人们的生产、生活造成了严重的影响。汽车尾气中含有CO、氮氧化物、烟尘等污染物,是导致雾霾天气的原因之一。请回答下列有关问题。
(1)下列说法正确的是________。
A.NO、CO、CO2均为酸性氧化物
B.CO2的大量排放会导致温室效应,所以应尽量选用公共交通,提倡低碳出
行
C.汽车尾气中的氮氧化物主要是空气中的氮气与氧气在高温条件下生成的
(2)为减轻污染,北京为汽车加装了“三效催化净化器”,可将尾气中的CO、NO转化为参与大气循环的无毒混合气体,反应如下:2NO+2CO N2+2CO2,则该反应的化学平衡常数表达式K=________。
N2+2CO2,则该反应的化学平衡常数表达式K=________。
(3)已知下列热化学方程式:
N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ·mol-1①
2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·mol-1②
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1③
则汽车尾气转化反应2NO(g)+2CO(g) N2(g)+2CO2(g)的ΔH=________。
N2(g)+2CO2(g)的ΔH=________。
(4)当固体催化剂质量一定时,增大其表面积可加快化学反应速率。如图表示在其他条件不变时,反应2NO(g)+2CO(g) N2(g)+2CO2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。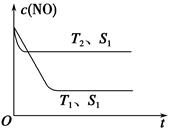
①图中T1________T2(填“>”或“<”)。
②若催化剂的表面积S1>S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。
(5)低温脱硝技术可用于处理各种废气中的氮氧化物,发生的化学反应为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
A.反应中每转移3 mol电子,生成标准状况下N2的体积为22.4 L
B.平衡时,若其他条件不变,增大NH3的浓度,废气中氮氧化物的转化率
减小
C.因为反应物比生成物的物质的量少,所以反应物比生成物的能量低
D.其他条件不变时,使用高效催化剂,废气中氮氧化物的转化率增大
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: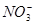 +4H++3e-=NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
+4H++3e-=NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:______________。
(2)反应中硝酸体现了________、_________的性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是___________mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是___________。
由稀有气体元素Xe(氙)形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入30 mL Mn2+浓度为0.1 mol·L-1的水溶液中,刚好完全反应,放出的唯一气体是Xe单质,其在标准状况下的体积为56 mL,在反应过程中溶液的pH不断减小。
(1)已知Mn2+在不同条件下,可被氧化为+4、+6、+7等不同价态,依据题目所给出的数据推算氧化产物中锰元素的化合价为____________。
(2)试写出有关的离子方程式:________________。
(3)若将反应后的溶液稀释至90 mL,则稀释后溶液的pH为____________。
某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中,H2O2只发生如下过程:H2O2―→O2。
(1)该反应的还原剂是____________。
(2)若反应转移了0.3 mol电子,则产生的气体在标准状况下的体积是______L。
(3)写出该反应的化学方程式:______________________。
2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Cu2+、Al3+ |
| 阴离子 |
SO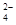 、HCO 、HCO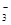 、NO 、NO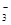 、OH- 、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出化学式:A、B________、C、D________.
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________.
(3)写出实验②发生反应的离子方程式______________________________________、
________________________________________________________________________.
(4)C常用作净水剂,用离子方程式表示其净水原理______________________________.
(有机化学基础)蜂胶是一种天然抗癌药
物,一个五六万只的蜂群一年只能产100多克蜂胶,所
以蜂胶又被誉为“紫色黄金”。蜂胶的主要活性成分为
咖啡酸苯乙酯,其分子结构如下图所示(短线表示化学
键,如单键、双键等),在一定条件下能发生如下转化: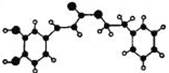

请回答下列问题:
(1)咖啡酸苯乙酯的分子式为,C结构简式为。
(2)① A中含氧官能团的名称为、。
② A 可以发生的反应是(填字母)
a 加成反应 b 酯化反应 c 消去反应 d 氧化反应
③ A 与甲醇反应生成B的化学方程式是。
(3)高分子E的结构简式是。
(4)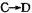 发生反应的反应类型是。
发生反应的反应类型是。
(5)B的同分异构体有很多种,其中同时符合下列条件的同分异构体的结构简式为。
a 苯环上只有两个取代基 b 能发生银镜反应 c 能与氢氧化钠溶液反应
d 不能与氯化铁溶液发生显色反应 e 核磁共振氢谱图中有三组峰