用NA表示阿伏加德罗常数的值。下列叙述中正确的是 ( )。
| A.7.8 g Na2O2中含有的阴离子数为0.2NA |
| B.铜与浓硫酸反应中,当转移的电子数为0.2NA时,生成的SO2为2.24 L |
| C.1 mol·L-1的NH4Cl溶液中的NH4+的数目小于NA |
| D.由NO2、O2组成的混合物中共有NA个分子,其中的氧原子数目为2NA |
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
| B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
C.CH3COOH 溶液加水稀释后,溶液中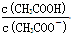 的值减小 的值减小 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s) + CO(g)  MgO(s) + CO2(g) +SO2(g) △H>0
MgO(s) + CO2(g) +SO2(g) △H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是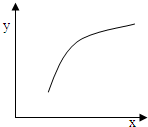
| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
MgSO4的质量(忽略体积) |
CO的转化率 |
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al + 3Ag2S =" 6Ag" + A12S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是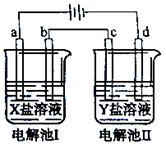
| 选项 |
X |
Y |
| A. |
MgSO4 |
CuSO4 |
| B. |
AgNO3 |
Pb(NO3)2 |
| C. |
FeSO4 |
Al2(SO4)3 |
| D. |
CuSO4 |
AgNO3 |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。
下列有关说法正确的是
| A.正极反应式:Ca+2Cl- - 2e-= CaCl2 |
| B.放电过程中,Li+向负极移动 |
| C.每转移0.1mol电子,理论上生成20.7gPb |
| D.常温时,在正负极间接上电流表或检流计,指针不偏转 |