下列对各组离子或物质是否能够大量共存解释正确的是( )。
| A |
常温常压下NH3、O2、H2、CO2 |
不能共存 |
NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B |
c(OH-)=1.0×10-13 mol·L-1溶液中,Fe2+、NO3—、SO42—、Na+ |
不能共存 |
发生反应:3Fe2++NO3—+4H+=3Fe3++NO↑+2H2O |
| C |
溶液中:K+、Cu2+、Cl-、NH3·H2O |
不能共存 |
发生反应:Cu2++2OH-=Cu(OH)2↓ |
| D |
溶液中:Al3+、Na+、SO42—、HCO3— |
可以共存 |
不能发生反应 |
若将15P原子的电子排布式写成1s22s22p63s23px23py1,它违背了()
| A.能量守恒原理 | B.泡利原理 | C.能量最低原理 | D.洪特规则 |
某元素原子价电子构型3d54s2,其应在
| A.第四周期ⅦB族 | B.第四周期ⅡB族 |
| C.第四周期ⅦA族 | D.第四周期ⅡA族 |
下列原子的价电子排布中,对应于第一电离能最大的是()
| A.3s23p1 | B.3s23p2 | C.3s23p3 | D.3s23p4 |
下列电子层中,原子轨道数目为4的是()
| A.K层 | B.L层 | C.M层 | D.N层 |
已知W、X、Y、Z四种短周期主族元素在周期表中的相对位置如图所示,下列有关说法正确的是( )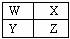
| A.Y的化学活泼性一定比W强 |
| B.Y元素的原子半径可能比X元素的小 |
| C.Z的气态氢化物的稳定性一定比X的强 |
| D.Z的原子序数可能是X的原子序数的2倍 |