有一澄清透明溶液,含有H+、Fe3+、Fe2+、Al3+、AlO2—、CO32—、NO3—中的几种,向溶液中逐滴加入1 mol·L-1 NaOH溶液,开始没有沉淀生成,后产生沉淀,沉淀达到最大量后继续滴加NaOH溶液时沉淀部分消失。下列判断正确的是 ( )。
| A.一定不含Fe3+和Fe2+ |
| B.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有 |
| C.溶液可能含有NO3— |
| D.一定含有Fe3+,一定不含Fe2+ |
现有1.0 mol/L的NaOH溶液0.2L,若通入4.48L(标准状况)SO2气体使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
| A.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+) |
| B.c(SO32―) + c( OH―) = c(H+) + c(H2SO3) |
| C.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―) |
| D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+) |
某芳香族化合物的分子式为C8H6O2,它的分子(除苯环外不含其它环)中不可能有
| A.两个羟基 | B.两个醛基 | C.一个羧基 | D.一个醛基 |
元素X和Y在元素周期表中位于相邻的两个周期,X与Y原子核外电子数之和为19,Y原子核内质子数比X多3个,则下列叙述不正确的是
| A.X和Y的单质间形成的化合物的化学式可能是Y2X或Y2X2 |
| B.元素X形成的化合物的种类比元素Y形成的化合物种类多 |
| C.Y的单质与硫酸铜溶液反应时有气体放出并有蓝色沉淀生成 |
| D.X和Y在自然界中只能以化合态存在 |
下列有关说法正确的是
| A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀 |
B.0.1 mol·L-1氨水加水稀释后,溶液中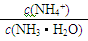 的值减小 的值减小 |
| C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是
| A.简单离子半径大小顺序:rW>rZ> rY |
| B.元素W的氧化物对应水化物的酸性比Y的强 |
| C.X与Y形成的原子晶体X3Y4的熔点可能比金刚石高 |
| D.X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |