利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收CO,能达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
[Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
| 温度/℃ |
15 |
50 |
100 |
| 化学平衡常数 |
5×104 |
2 |
1.9×10-5 |
下列说法正确的是 ( )。
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)]Ac·CO Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
C.保持其他条件不变,减小压强,CO的转化率减小
D.醋酸二氨合铜溶液的浓度大小对CO的吸收没有影响
有一无色透明溶液,可能含有Na+,Al3+,Mg2+,Fe3+,NH4+,Cl-,SO42—,HCO3—中的几种,取该溶液三份分别进行实验:①滴加甲基橙溶液显红色;②逐渐加入NaOH溶液,产生白色沉淀,最后白色沉淀部分溶解;③加入5 mL 0.1 mol·L-1 BaCl2溶液至不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.2 g沉淀。由此推知,原溶液中( )
| A.一定有Al3+,Mg2+,Cl-,SO42— |
| B.一定没有Mg2+,Fe3+,HCO3— |
| C.不能确定是否含有Cl- |
| D.可能有Na+,NH4+,Cl-,SO42— |
下列叙述正确的是( )
| A.丁达尔效应是区分溶液和胶体的一种常用物理方法 |
| B.氯化钠溶液蒸发结晶时,必须将蒸发皿中的液体蒸干才能停止加热 |
| C.实验室可用KOH稀溶液除去NaCl溶液中混有的少量MgCl2杂质 |
| D.测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |
下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 |
结论 |
|
| A |
向装有Fe(NO3)2溶液的试管中加入稀硫酸,在管口观察到红棕色气体 |
HNO3分解成了NO2 |
| B |
向淀粉溶液中加入质量分数为20%的硫酸,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 |
淀粉没有水解成葡萄糖 |
| C |
甲烷和氯气混合后在光照下,颜色逐渐褪去 |
甲烷和氯气发生了化合反应 |
| D |
向饱和Na2CO3中通入足量CO2,溶液变浑浊 |
析出了NaHCO3 |
对于实验甲~丁的实验现象预测正确的是( )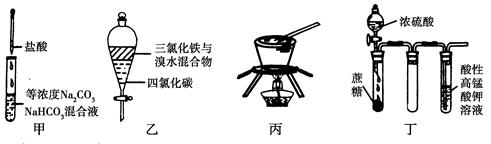
| A.实验甲:逐滴滴加盐酸时,试管中立即产生大量气泡 |
| B.实验乙:充分振荡后静置,下层溶液为橙红色,上层无色 |
| C.实验丙:从饱和食盐水中提取NaCl晶体 |
| D.装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去 |
不能用带橡胶塞的玻璃试剂瓶存放的药品是( )
①浓硝酸 ②稀氢氧化钠溶液 ③液溴 ④纯碱溶液⑤水玻璃 ⑥氢氟酸
| A.①③⑥ | B.①④⑥ | C.①⑤⑥ | D.②③④⑤ |