在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g),图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。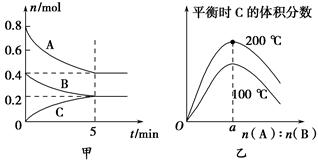
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
B.由图乙可知,反应xA(g)+yB(g)zC(g)的ΔH<0,且a=2
C.若在图甲所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
| A.三种酸的电离常数Ki(HX)> Ki(HY)> Ki(H2CO3) |
B.结合H+的能力:Y->CO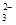 >X->HCO >X->HCO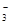 |
| C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
D.NaX溶液中通入足量CO2后的离子浓度:C(Na+)>c(HCO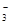 )>C(X-)>c(OH-)>c(H+) )>C(X-)>c(OH-)>c(H+) |
下列解释实际应用的原理表达式中,不正确的是
A.用排饱和食盐水法收集 : :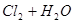 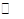 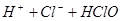 |
B.热的纯碱溶液碱性增强: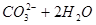 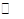 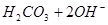 |
C.向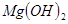 悬浊液中加入 悬浊液中加入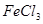 溶液: 溶液: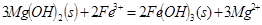 |
D.配制FeCl3溶液时为防止溶液浑浊常加入少量稀盐酸Fe3++3H2O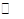 Fe(OH)3+3H+, Fe(OH)3+3H+, |
下列说法正确的是
A.某温度时,1LpH=6的水溶液,含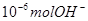 离子 离子 |
B.含10.6gNa2CO3溶液中,所含阴离子总数等于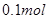 |
| C.VLamol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。 |
D.电解精炼粗铜时,每转移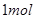 电子,阳极上溶解的 电子,阳极上溶解的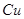 原子数必为 原子数必为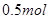 |
25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是
| A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B.pH =11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)> c(OH-)>c(H+) |
| C.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH) =" 0.1" mol·L-1 |
| D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性 c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
将0.1mol/L的醋酸钠(NaAc)溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
| A.c(Ac-)>c(Cl-)>c(H+)>c(HAc) |
| B.c(Ac-)>c(HAc)>c(Cl-)>c(H+)>c(OH-) |
| C.c(Ac-)=c(Cl—)>c(H+)>c(HAc) |
| D.c(Na+)+ c(H+)=c(Ac-)+ c(Cl-)+ c(OH-) |