下列类推正确的是 ( )。
| A.CaCO3与稀硝酸反应生成CO2,CaSO3也能与稀硝酸反应生成SO2 |
| B.铜在氯气中剧烈燃烧生成二价铜,铜也能在硫蒸气中剧烈燃烧生成二价铜 |
| C.锌可以与溶液中的银离子发生置换反应,钠也能与溶液中的银离子发生置换反应 |
| D.钠与乙醇反应产生氢气,钾与乙醇也能反应产生氢气 |
下列关于燃烧热的描述中正确的是( )
| A.已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=-4b kJ·mol-1 |
B.将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1 |
D.葡萄糖的燃烧热是2800kJ·mol-1,则 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1 |
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为()
| A.-44.2 kJ·mol-1 | B.+44.2 kJ·mol-1 | C.-330 kJ·mol-1 | D.+330 kJ·mol-1 |
下列有关中和热的说法正确的是( )
| A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH=-57.3 kJ/mol |
| B.准确测量中和热的实验过程中,至少需测定温度4次 |
| C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 |
| D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),
下列有关说法正确的是()
| A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.工业上金属钠是通过氯碱工业制取 |
| C.从第③步到第⑤步的目的是为了浓缩 |
| D.在第③④⑤步中溴元素均被氧化 |
某有机物分子中含有n个 -CH2-, m个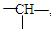 , a个-CH3,其余为-Cl,则-Cl的个数为
, a个-CH3,其余为-Cl,则-Cl的个数为
| A.2n+3m-a | B.n+m+a | C.m+2-a | D.m+2n+2-a |