工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下: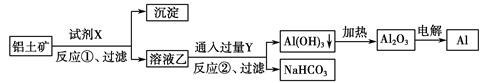
下列叙述正确的是( )。
| A.试剂X可以是氢氧化钠溶液,也可以是盐酸 |
| B.反应①、过滤后所得沉淀为氢氧化铁 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
烃分子中碳、氢两种元素质量比为5:1,且分子中含有3个甲基,则该烃分子的一氯代物共有几种(不考虑空间异构)
| A.1 | B.2 | C.3 | D.4 |
设NA为阿伏伽德罗常数的值,下列说法正确的是
| A.6.8g液态KHSO4中含有0.1NA个阳离子 |
| B.NA个Fe(OH)3胶体粒子形成的纳米材料的质量为107g |
| C.含有4.6g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA |
| D.5NH4NO3=2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数为15NA |
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
| A.Fe | B.Na | C.Al | D.K |
有一混合物的水溶液,只可能含以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42 -,现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加过量NaOH溶液加热后收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
③在甲溶液中通过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
④第三份加足量BaCl2溶液后得白色沉淀,沉淀经足量盐酸洗涤干燥后质量为11.65 g。
根据上述实验回答: ___________, 不能确定是否存在的离子是________________。
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):
离子符号______,浓度_____________;
离子符号______,浓度_______________;
离子符号______,浓度________________;
(3)试确定K+ 是否存在________(填“是”或“否”),判断的理由是 ______________。
镁铁混合物13.8g溶解在足量某浓度的稀硝酸中,完全反应,其还原产物只有一氧化氮(0.3mol),则向反应后的溶液中加入足量的NaOH溶液,可生成的沉淀质量为
| A.26 | B.29.1g | C.29.5g | D.24g |