下列离子方程式书写正确的是
| A.Cu(OH)2中加入硫酸:OH- + H+ = H2O |
| B.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3+ + 3SO42-+ 3Ba2+ + 6OH-= 2Al(OH)3↓ + 3BaSO4↓ |
| C.钠加入水中:Na+ 2H2O= Na+ + 2OH- + H2↑ |
D.向浓盐酸中加二氧化锰:MnO2+ 4H+ + 2Cl- Mn2+ + 2H2O + Cl2↑ Mn2+ + 2H2O + Cl2↑ |
下列叙述中,正确的是( )
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
| A.①②③④ | B.③④ | C.③④⑤ | D.④ |
下列说法正确的是( )
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 0 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
| A.③①④②⑤ |
| B.①③⑤④② |
| C.③②①⑤④ |
| D.⑤②④①③ |
在由水电离出的c(OH-)=1×10-13 mol·L-1的溶液中,能大量共存的离子组是( )
| A.Fe2+ Na+ N O3- Cl- |
| B.Ba2+ Na+ N O3- Cl- |
| C.S2- S N Na+ |
| D.Mg2+ Na+ Br- ClO- |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )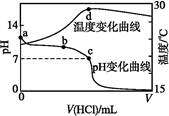
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
| B.b点:c( NH4)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(N) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |