25 ℃、101 kPa下:①2Na(s)+O2(g)=Na2O(s) ; ΔH1=-414 kJ/mol
②2Na(s)+O2(g)=Na2O2(s) ; ΔH2=-511 kJ/mol
下列说法正确的是
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s) ; ΔH=-317 kJ/mol |
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)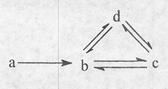
| a |
b |
c |
d |
|
| ① |
Si |
SiO2 |
H2SiO3 |
Na2SiO3 |
| ② |
Al |
AlCl3 |
NaAlO2 |
Al(OH)3 |
| ③ |
Cu |
CuO |
Cu(OH)2 |
CuSO4 |
| ④ |
Na |
NaOH |
Na2CO3 |
NaHCO3 |
| A.①② | B.②③ | C.③④ | D.②④ |
下列实验能达到目的的是
| A.分别加热蒸干灼烧NaAlO2溶液和AlCl3溶液,最终都能得到Al2O3 |
B.在滴有酚酞的 Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 |
C.检验Fe2O3中是否含有FeO,用盐酸溶解样品后,滴加高锰 酸钾溶液,观察溶液紫色是否褪色或变浅 酸钾溶液,观察溶液紫色是否褪色或变浅 |
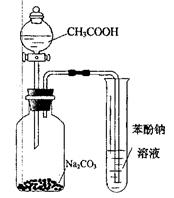
| D.利用图示装置并根据有关实验现象能推知酸性: CH3COOH>H2CO3>C6H2OH |
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.lmol Na2O2晶体中共含有4NA个离子 |
| B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| C.常温常压下16gO2和O3混合气体含有NA个氧原子 |
D.电解精炼铜时每转移NA个电子,阳极溶解32g 铜 铜 |
下列说法正确的是
| A.发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 |
| B.碘盐中的碘可以直接用淀粉检验 |
| C.碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝等可用于治疗胃酸过多 |
| D.硫酸氢钠属于盐类,其水溶液显中性 |
下列指定物质在一定条件下完全反应,转移2mole-的是
| A.1mol Cl2在点燃条件下与足量铁屑反应 | B.1mol NO2与水反应 |
| C.1mol H2O2分解 | D.1mol Cl2与NaOH溶液反应 |