25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应: Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是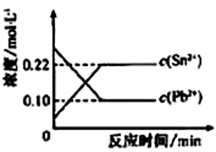
| A.往平衡体系中加入少量金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应的△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
| A.FeCl3 | B.FeS |
| C.NaCl | D.FeCl2 |
| A.CO2与CO | B.H2O与D2O |
| C.D与T | D.O2与O3 |
用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,下列说法正确的是
| A.阴极的电极反应式为Cu2++2e-====Cu,当有Cu2+时,Fe3+不放电 |
| B.阴极上首先析出铁,然后析出铜 |
| C.首先被电解的是Fe2(SO4)3溶液,后被电解的是CuSO4溶液 |
| D.阴极上不可能析出铜 |
电解水时,为增强水的导电性,需加入一定量的电解质,但不宜加入的是
| A.KNO3 | B.NaCl | C.H2SO4 | D.NaOH |
电解下列物质的水溶液时,阴极上无金属析出的是
| A.CuCl2 | B.HgCl2 | C.AgNO3 | D.NaOH |