已知下列热化学方程式:Zn(s) + 1/2 O2(g)= ZnO(s) △H1;Hg(l) + 1/2 O2(g)=HgO(s) △H2;
则 Zn(s)+ HgO(s)=Hg(l)+ ZnO(s),△H值为
| A.△H2-△H1 | B.△H2+△H1 | C.△H1-△H2 | D.-△H1-△H2 |
下列溶液中微粒的物质的量浓度关系正确的是
| A.pH相等的CH3COONa、NaClO、NaHCO3三种溶液: c(CH3COONa) > c(NaClO) > c (NaHCO3) |
| B.Na2CO3溶液:c(OH-)—c(H+)=c(HCO3-)+ c(H2CO3) |
| C.等浓度的NaClO、NaHCO3混合溶液中: c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3) |
| D.0.1 mol·L-1的KHA溶液,其pH=10:c(HA-)> c(OH-)> c(H+)> c(A2-) |
某新型铝-空气燃料电池,以铝合金为负极,在正极通入空气,若以NaCl溶液或NaOH溶液为电解质溶液,放电时正极反应都为O2+2H2O+4e-=4OH-。下列说法正确的是
| A.以NaCl溶液或NaOH溶液为电解质溶液,两个电池总反应相同。 |
| B.若以NaOH溶液为电解质溶液,电池负极反应为:Al+4OH--3e-=[Al(OH)4]- |
| C.电池工作时,电子通过外电路从正极流向负极 |
| D.若以NaOH溶液为电解质溶液,电池在工作过程中电解质溶液的pH保持不变 |
下列离子方程式书写正确的是
| A.Na2SO3溶液中加入稀硝酸: SO32-+2H+ ==SO2↑+H2O |
B.NH4HSO3溶液与少量的NaOH溶液混合加热:NH4++OH- NH3↑+2H2O NH3↑+2H2O |
| C.FeBr2溶液中通入足量的Cl2: 4Fe2++4Br-+3Cl2==4Fe3++2Br2+6Cl- |
| D.向碳酸氢钙溶液加入少量氢氧化钾溶液: |
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32—
氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3++N2+3C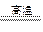 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.AlN是氧化产物 |
| C.上述反应中,每生成1molAlN需转移3mol电子 |
| D.上述反应中,C元素被还原 |
下表所列各组物质中,物质之间通过一步反应就不能实现如图所示转化的是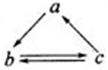
| 物质选项 |
a |
b |
c |
| A |
Al2O3 |
AlCl3 |
Al(OH)3 |
| B |
C |
CO |
CO2 |
| C |
SiO2 |
Na2SiO3 |
H2SiO3 |
| D |
Fe |
FeCl3 |
FeCl2 |