能源短缺是人类社会面临的重大问题,世界各国都在努力寻找新能源,探求绿色能源的开发。甲醇是一种可再生能源,是一种污染性较小,热值较大的能源,因而具有广泛的开发价值和良好的应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:
反应Ⅱ:
①上述反应符合“原子经济”原则的是_________(填“I’’或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
由表中数据判断△H1_________0(填“>”、“=”或“<”),说明生成物的总能量一定_______(填“>”、“=”或“<”)反应物的总能量。
③反应Ⅱ反应历程如下图,回答下列问题;在反应体系中加入催化剂,反应速率增大,E1、E2和△H2的变化是:E1_________、E2_________、△H2_________(填“增大”“减小”“不变”)。
(2)最新研制的一种新型甲醇电池示意图如图,电池的两极分别充人甲醇和氧气(池内为酸性介质)。则电池工作时____________(填a或b)为正极,a极的电极反应式为______________。
反应 在四种不同情况下的反应速率分别为
在四种不同情况下的反应速率分别为 ②
② ③
③ ④
④
该反应进行的快慢顺序为。
(7分)对于反应2SO2+O2 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
升高温度 |
|
| ② |
降低温度 |
|
| ③ |
增大氧气的浓度 |
|
| ④ |
使用催化剂 |
|
| ⑤ |
压缩体积 |
|
| ⑥ |
恒容下充入Ne |
|
| ⑦ |
恒压下充入Ne |
已知:①FeS不溶解于水;②实验室制取H2S、SO2气体的原理是:
FeS+H2SO4=FeSO4+H2S↑ Na2SO3+H2SO4=Na2SO4+H2O+SO2↑
③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2=3S+2H2O
根据下图中A~D的实验装置和试剂进行实验,回答下列问题:
⑴装置A是由双孔塞、玻璃导管及和组装起来的
⑵组装一套制取SO2气体的装置,并证明SO2既有氧化性、又有还原性和漂白性
①按实验装置连接顺序,把a f各导管口连接起来,正确的顺序有
f各导管口连接起来,正确的顺序有
| A.befcda | B.adcefb | C.acdfeb | D.acdefb |
②若C装置中的溶液为,反应后该溶液变为无色,说明SO2具有还原性;
③若C装置中的溶液为,反应后该溶液变为无色,说明SO2具有漂白性;
④当D中产生现象时,说明SO2具有氧化性;
(3)D装置烧杯中NaOH溶液的作用。
下图是元素周期表的框架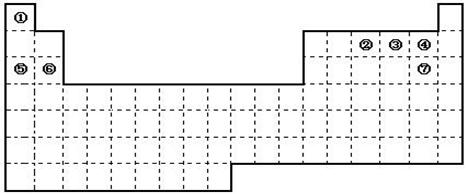
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)依据元素周期表回答下列问题:
| A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是(用化学式表示)。 |
| B.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是(用化学式表示)。 |
| C.①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是(填写结构式)。 |
| D.在上面元素周期表中全部是金属元素的主族是;全部是非金属元素的主族是(填写字母a、b、c、d)。 |
a.ⅠA族 b. ⅡA族 c. ⅥA 族 d.ⅦA族
(3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 ;
(4)请写出仅用①②④三种元素形成离子化合物的电子式_________。若用球棍模型表示①和③形成的化合物的分子结构,应该是。
⑸在120℃下1g①的单质在足量③的单质中完全燃烧,放出的热量为a kJ;请写出此条件下①的单质燃烧的热化学方程式 ;
①、③两种元素的单质已被应用于字宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。
请回答:b是电池的极;a电极上的电极反应式是 。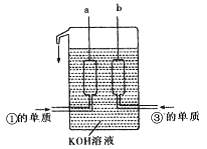
(8分)有下列八种晶体
| A.金刚石 | B.蔗糖 | C.氧化镁 | D.白磷 E.晶体氩 |
F.铝 G.水晶 H 氢氧化钠,用序号回答下列问题:
(1)只有离子键构成的化合物是 。
(2)直接由原子构成的分子晶体是 。
(3)在常温下能导电的是 。
(4)受热熔化时,需克服共价键的化合物是 。