化学中常借助曲线图来表示某种变化过程,有人分别画出了下列的四个曲线图:
有关上述曲线图的说法正确的是:
| A.曲线图①可以表示恒压容器中某化学平衡体系充入气体生成物后反应速率随时间的变化 |
| B.曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的盐酸时的pH的变化 |
| C.曲线图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时的产生沉淀的物质的量变化 |
| D.曲线图④可以表示冰醋酸加水稀释过程中溶液中c(H+)的变化 |
一定温度下的反应A(g)+3B(g) 2C(g),下列叙述不能表明它达到化学平衡的是
2C(g),下列叙述不能表明它达到化学平衡的是
A.A、B、C的浓度不再变化
B.混合气体的总物质的量不再变化
C.单位时间内生成a mol A,同时生成3amol B
D.C的生成速率与C的分解速率相等
高温下,某反应达平衡,平衡常数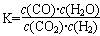 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO + H2 O CO2+ H2 CO2+ H2 |
关于下列四个图像的说法中不正确的是
A.图①表示可逆反应: CO(g) + H2O(g) CO2(g)+ H2(g) ΔH<0 CO2(g)+ H2(g) ΔH<0 |
| B.图②表示电解氯化钠的稀溶液,阴、阳两极产生气体体积之比一定是1∶1 |
C.图③表示可逆反应:A2(g)+ 3B2(g) 2AB3(g)ΔH >0 2AB3(g)ΔH >0 |
D.图④表示压强对可逆反应2A(g)+ 2B(g) 3C(g)+ D(s)的影响,乙的压强大 3C(g)+ D(s)的影响,乙的压强大 |
根据右表提供的数据,判断在等物质的量浓度的NaClO
和NaHCO3混合溶液中,各种离子浓度关系正确的是
| A.c(Na+)>c(HCO3-)+c(ClO-)+2c(CO32-) |
| B.c(ClO-)>c(HCO3-)>c(H+) |
| C.c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) |
设nA 代表阿伏加德罗常数(NA )的数值,下列说法正确的是
| A.1 mol 硫酸钾中阴离子所带电荷数为nA |
| B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有3nA 个氢原子 |
| C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为nA |
| D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA个Fe3+ |