下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
己知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O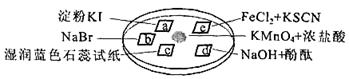
对实验现象的“解释或结论”正确的是
| 选项 |
实验现象 |
解释或结论 |
| A |
a处变蓝,b处变红棕色 |
氧化性:Cl2>Br2>I2 |
| B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
| C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
| D |
e处变红色 |
还原性:Fe2+ > Cl- |
甲、乙两种非金属:①甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;②甲比乙更容易与氢气化合;③甲单质能与乙阴离子发生氧化还原反应;④与金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说明甲比乙的非金属性强的是()
| A.①②③④ | B.①②③④⑤ | C.①②③ | D.②③④⑤ |
核内中子数为N的R2+,质量数为A,则ng它的同价态氧化物中所含电子物质的量为()
A.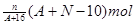 |
B. |
C.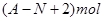 |
D.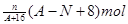 、 、 |
下列各组顺序的排列不正确的是()
| A.离子半径:Na+>Mg2+>Al3+>F- | B.热稳定性:HCl>H2S>PH3>AsH3 |
| C.酸性强弱:H3AlO3<H2SiO3<H2CO3<H3PO4 | D.碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
向四支试管中分别加入少量不同的无色溶液,再分别进行如下操作,结论正确的是()
| 操作 |
现象 |
结论 |
|
| A |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中有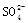 |
| B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显橙红色 |
原溶液中有Br― |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+、无K+ |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
下表为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中,正确的是()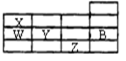
A.常压下,五种元素的单质中,Z单质的沸点最高
B.W的氢化物比X的氢化物的稳定性高
C.Y、Z的阴离子电子层结构都与B原子的相同
D.Y元素比W元素的非金属性强