PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是
| A.1:2混合的PbO2、Pb3O4 |
| B.1:1混合的Pb3O4、PbO |
| C.1:2:4混合的PbO2、Pb3O4、PbO |
| D.1:4:1混合的PbO2、Pb3O4、PbO |
2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是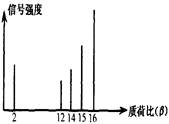
| A.甲醇 | B.甲烷 | C.丙烷 | D.乙烯 |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)
| A.5种 | B.6种 | C.7种 | D.8种 |
等质量的钠进行下列实验,其中生成氢气最多的是
| A.将钠投入到足量水中 |
| B.将钠放入足量稀盐酸中 |
| C.将钠放入足量稀硫酸中 |
| D.将钠用铝箔包好并刺一些小孔,再放人足量的水中 |
检验氨气可以选用
| A.湿润的蓝色石蕊试纸 | B.干燥的红色石蕊试纸 |
| C.干燥的蓝色石蕊试纸 | D.湿润的红色石蕊试纸 |