下列各溶液中,离子的物质的量浓度关系正确的是
| A.(NH4)2SO4溶液中 c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.Na2S稀溶液中 c(Na+)=c(S2-)+c(H2S)+c(HS-) |
| C.饱和食盐水中 c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.CH3COOH溶液加水稀释后,溶液中所有离子浓度都减小 |
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5L |
0.5L |
1. 0L |
| 温度/℃ |
T1 |
T2 |
T2 |
| 反应物 起始量 |
1.5molA 0.5 molB |
1.5 molA 0.5 molB |
6.0 molA 2.0 molB |

下列说法正确的是
A.l0min内甲容器中反应的平均速率v(A)=0.025mol·(L·min)-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
下列有机物只有四种同分异构体的是
| A.分子式为C4H10烷烃的二氯取代物 |
| B.分子式为C3H9N的有机物,其中N原子以三个单键与其他原子相连 |
| C.乙苯苯环上的二氯取代物 |
| D.分子式为C4H8的有机物 |
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)  N2O4(g)△H=-akJ/mol(a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,
N2O4(g)△H=-akJ/mol(a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,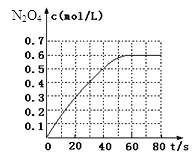
若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是
| A.v(正)>v(逆) | B.v(正)<v(逆) |
| C.v(正)=v(逆) | D.v(正)、v(逆)大小关系不确定 |
下列说法正确的是
① 标准状况下,6.02×1023个分子所占的体积约是22.4L
②0.5molH2所占体积为11.2L
③标准状况下,1molH2O的体积为22.4L
④标准状况下,28gCO与N2的混合气体的体积约为22.4L
⑤各种气体的气体摩尔体积都约为22.4L/mol
⑥标准状况下,体积相同的气体的分子数相同
| A.①③⑤ | B.④⑥ | C.③④⑥ | D.①④⑥ |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关该反应的说法正确的是
| A.NF3是氧化剂,H2O是还原剂 |
| B.HF是还原产物 |
| C.还原剂和氧化剂的物质的量之比是2:1 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |