下列陈述Ⅰ、Ⅱ都正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
非金属性:Cl>S |
酸性:HClO> H2SO3 |
| B |
SO2有氧化性 |
SO2能使酸性KMnO4溶液褪色 |
| C |
NH3.H2O为一元弱碱 |
含有NH4+的水溶液均显弱碱性 |
| D |
锌的金属性比铁强 |
海轮外壳上装锌块可减缓腐蚀 |
下列四个图像的有关描述错误的是 ( )
注:ΔE:表示能量,p表示压强;t表示时间,V表示体积,%表示B的体积百分含量。
A.图1表示化学反应2S02(g)+O2(g)  2S03(g)的能量变化,该反应的ΔH=A一BkJ/mol 2S03(g)的能量变化,该反应的ΔH=A一BkJ/mol |
B.图2表示其他条件不变时,反应2A(g)+B(g)  c(g) +D(g)在不同压强下随时间的变化 c(g) +D(g)在不同压强下随时间的变化 |
| C.图3表示体积和浓度均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
| D.图4表示100 ml O.1 mol·L—Na2C03和NaHC03两种溶液中,分别逐滴滴加O.1 mol·L-HCl,产生CO2的体积随盐酸体积的变化,则b表示NaHCO3溶液 |
下列叙述正确的是 ()
A.恒容密闭容器中进行的反应3A(g)  B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大 B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大 |
B.对于可逆反应N2(g)+3H2(g)  2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加 |
| C.将A1C13溶液和NaAlO2溶液分别蒸干后灼烧,所得固体产物均为A1203 |
D.反应NH3(g)+HCl(g)  NH4C1(s) ΔH<O在任何条件下均能自发进行 NH4C1(s) ΔH<O在任何条件下均能自发进行 |
在密闭容器中进行反应CH4(g)+H20(g)  CO(g)+3H2(g) ΔH>0测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
CO(g)+3H2(g) ΔH>0测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )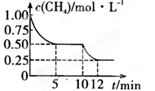
| A.10 min时,改变的外界条件可能是温度 |
| B.0~5 min内,V(H2)=0.1 mol·L-·min— |
| C.恒温下,缩小容器体积,平衡后c(H2)肯定减小 |
| D.10—12 min时反应的平衡常数逐渐增大 |
为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是 ( )
| 物质 |
试剂 |
分离方法 |
|
| ① |
硝酸钾(氯化钠) |
蒸馏水 |
降温结晶 |
| ② |
二氧化碳(氯化氢) |
饱和碳酸钠溶液 |
洗气 |
| ③ |
乙醇(水) |
金属钠 |
蒸馏 |
| ④ |
NaCl溶液(Na2S) |
AgCl |
过滤 |
A.①③ B.①④ C.只有② D.③④
对于 0.1 mol/L Na2SO3溶液,正确的是( )
| A.升高温度,溶液 pH 降低 |
B.c(Na+)=2c(SO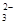 )+c(HSO )+c(HSO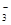 )+c(H2SO3) )+c(H2SO3) |
C.c(Na+)+c(H+)=2c(SO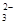 )+2c(HSO )+2c(HSO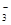 )+c(OH-) )+c(OH-) |
D.加入少量 NaOH 固体,c(SO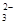 )与c(Na+)均增大 )与c(Na+)均增大 |